Химия металлов :: Основы химии металлов :: Металлы. Простые вещества :: Химические свойства металлов
Щелочные металлы образуют катион типа Ме+, s-металлы второй группы образуют катионы Ме2+.Металлы р-блока при растворении в кислотах образуют катионы, указанные в таблице.
Металлы Pb и Bi растворяют только в азотной кислоте.
| Me | Al | Ga | In | Tl | Sn | Pb | Bi |
| Mez+ | Al3+ | Ga3+ | In3+ | Tl+ | Sn2+ | Pb2+ | Bi3+ |
| Eo,B | –0,55 | –0,34 | –0,34 | –0,14 | –0,13 | +0,317 |
Все d-металлы 4 периода, кроме Cu, могут быть окислены ионами Н+ в кислых растворах.
Типы катионов, образуемых d-металлами 4 периода:
- Ме 2+ (образуют d-металлы начиная от Mn до Cu)
- Ме 3+ (образуют Sc, Ti , V , Cr и Fe в азотной кислоте).
- Ti и V образуют также катионы МеО 2+
В кислых растворах Н+ может окислить: Y, La, Сd.
В HNO3 могут растворяться: Cd, Hg, Ag. В горячей HNO3 растворяются Pd, Tc, Re.
В горячей H2SO4 растворяются: Ti, Zr, V, Nb, Tc, Re, Rh, Ag, Hg.
Металлы: Ti, Zr, Hf, Nb, Ta, Mo, W обычно растворяют в смеси HNO3 + HF.
В царской водке (смеси HNO3 + HCl) можно растворить Zr, Hf, Mo, Tc, Rh, Ir, Pt, Au и Os с трудом). Причиной растворения металлов в царской водке или в смеси HNO3 + HF является образование комплексных соединений.
Пример. Растворение золота в царской водке становится возможным из-за образования комплекса [AuCl4]—
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Характерные химические свойства щелочных металлов » HimEge.ru
•Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
•Все соединения щелочных металлов имеют ионный характер.
•Практически все соли растворимы в воде.
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги. Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
1. Щелочные металлы активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Получение щелочных металлов
Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl
В небольших масштабах используется также вакуум-термическое получение натрия и калия:
2NaCl+CaC2=2Na+CaCl2+2C;
4KCl+4CaO+Si=4K+2CaCl2+Ca2SiO4.
Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s22s1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li+ со стабильной конфигурацией инертного газа (гелия). Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл. От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li
Малый размер иона Li+, высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е—, занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s22s22p63s1. Единственная степень окисления натрия +1. Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na
Физиологическое значение ионов К+ и Na+ связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами. Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К+, вследствие чего внутриклеточная концентрация К
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв. Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте. При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов. В соединениях калия связь более ионная, а в виде иона К+ он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39К, 40К, 41К. Один из них 40К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа. Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р. Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей. Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации. Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (390C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах. Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно. Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах. В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li3N (до 75%) и Li2O. Остальные щелочные металлы образуют пероксиды (Na2O2) и надпероксиды (K2O4 или KO2).
Перечисленные вещества реагируют с водой:
Li3N + 3 H2O = 3 LiOH + NH3 ;
Na2O2 + 2 H2O = 2 NaOH + H2O2 ;
K2O4 + 2 H2O = 2 KOH + H2O2 + O2 .
Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
Na2O2+CO2=Na2CO3+0,5O2 ;
K2O4 + CO2 = K2CO3+ 1,5 O2 .
В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных.
Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
2Li+H2=2LiH.
Гидрид лития используется как сильный восстановитель.
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
SiO2+2NaOH=Na2SiO3+H2O.
Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 13000С). Некоторые соединения натрия называют содами:
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na2CO3;
б) кристаллическая сода – кристаллогидрат карбоната натрия Na2CO3.10H2O;
в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO3;
г) гидроксид натрия NaOH называют каустической содой или каустиком.
Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Тема: Основные металлы и неметаллы
Урок: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
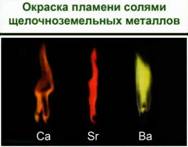

Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S 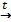 Na2S
Na2S
2Na + H2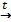 2NaH
2NaH
3Na + P 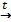 Na3P
Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3H2O → 3LiOH + NH3↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H2O → 2LiOH + H2↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
NaOH |
Едкий натр (каустическая сода) |
|
NaCl |
Поваренная соль |
|
NaNO3 |
Чилийская селитра |
|
Na2SO4∙10H2O |
Глауберова соль |
|
Na2CO3∙10H2O |
Сода кристаллическая |
|
KOH |
Едкое кали |
|
KCl |
Хлорид калия (сильвин) |
|
KNO3 |
Индийская селитра |
|
K2CO3 |
Поташ |
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S 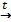 СaS
СaS
Сa + H2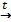 СaH2
СaH2
3Сa + 2P 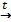 Сa3 P2-
Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 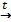 3Ba + Al2O3
3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
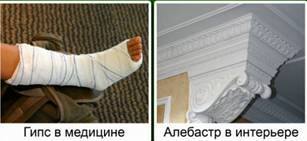
Рис. 2
СaO + H2O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.

Рис. 3
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.

Рис. 4
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 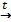 CaCO3↓ + СО2↑ + Н2О
CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов H2PO4— ,Cl—, NO3— и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.

Рис. 5
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
Химические свойства алюминия
1. Реакция с галогенами
2Al + 3I2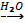 2AlI3
2AlI3
2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2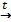 2Al2O3 + Q . При этом может развиваться температура до 35000С.
2Al2O3 + Q . При этом может развиваться температура до 35000С.
3. Реакция с неметаллами
2Al + 3S  Al2S3
Al2S3
2Al + N2 2AlN
2AlN
4Al + 3С  Al4С3
Al4С3
4. Взаимодействует с водой
2Al + 6H2O → 2Al(OH)3 +3H2↑ Если снять амальгамированием или механически пленку.
Амальгамирование – это нанесение на поверхность небольшого количества ртути.
5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
6. Взаимодействует с кислотами-неокислителями
2Al + 6HCl →2AlCl3 + 3H2↑
Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ (амфотерные свойства).
Al2O3 + 2NaOH = 2NaAlO2 + H2O
8. Реагирует с растворами солей
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Применение алюминия

Рис. 6
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия. Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов. Используется как конструкционный материал в авиа- и машиностроении.
Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
Na2O2 + CO2 → Na2CO3 + 1/2O2
KO2 + CO2 → K2CO3 + 3/2O2
Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях. Но там не должно происходить перепада давления.
Подведение итога урока
На уроке была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды. Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик.ру (Источник).
Домашнее задание
1. №№3, 4, 5-а (с. 173) Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
2. Какую реакцию среды имеет водный раствор сульфида калия? Ответ подтвердите уравнением реакции гидролиза.
3. Определите массовую долю натрия в морской воде, которая содержит 1,5% хлорида натрия.
Какие металлы реагируют с водой?
Железо, Алюминий, Кальций, Литий, Цинк, Медь…. да практически все, только при определенных условиях. Если тебя интересует Которые из них при нормальных (естественных) условиях то Кальций, Литий, натрий, калий.
С водой реагируют металлы, расположенные левее Ас (актиния) ) в электрохимическом ряду активности металлов (см. ) Для школы — хватит, а вот если подробнее, то надо рассуждать про окислительно-восстановительнй (водородный) потенциал. А вот Александр-Анатолии крепко не прав. Металлы расположенные правее водорода могут вытеснять водород из кислот.. . И не более!
Вервая и вторая группы ГЛАВНЫЕ ПОДГРУППЫ (А
В первую очередь нужно запомнить, что малоактивные металлы (т. е. те, что расположены после водорода) с водой не реагируют ни при каких условиях. Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например: 2Na + 2h3O = 2NaOH + h3↑ Ca + 2h3O = Ca(OH)2 + h3↑ Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим: Mg + 2h3O = Mg(OH)2↓ + h3↑ Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония: 2Al + 6h3O = 2Al(OH)3 + 3h3↑ Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 оС). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород: Zn + 2h3O = Zn(OH)2 + h3↑ 3Fe + 4h3O = Fe3O4 + 4h3 или Fe + h3O = FeO + h3 (в зависимости от степени нагрева)
Химические свойства щелочных металлов.
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
4Li + O2 = 2Li2O
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
2Na + O2 = Na2O2,
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
K + O2 = KO2
Rb + O2 = RbO2
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
6Li + N2 = 2Li3N нитрид лития
6K + N2 = 2K3N нитрид калия
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН-1гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2K = K2S сульфид калия
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
2CH3OH + 2К = 2CH3OК + H2↑
метилат калия
2C6H5OH + 2Na = 2C6H5ONa + H2
фенолят натрия
Характерные химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
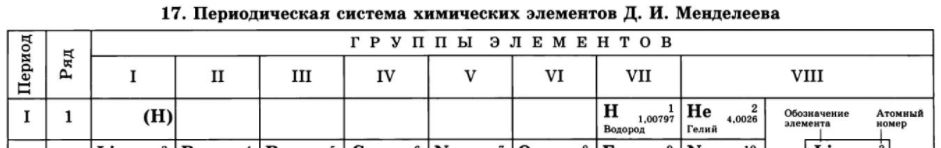
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:

Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген | Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:

При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:

При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:

серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:

Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:

Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:


Остальные галогены реагируют со всеми металлами кроме платины и золота:





Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:




Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:

Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Щелочные металлы, подготовка к ЕГЭ по химии
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвит
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
Li + O2 → Li2O (оксид лития)
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
Na2O2 + Na → Na2O
KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
K + H2O → KOH + H2↑
Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
NaOH + MgBr2 → NaBr + Mg(OH)2↓
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием оксиелов — смешанных оксидов (при высоких температурах — прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется оксиел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
Подобная схема универсальная для брома и для йода. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO + NaI + H2O (без нагревания)
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
LiOH + NO2 → LiNO2 + LiNO3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
