ОГЭ. Взаимодействие веществ с водой
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2.
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
Mg + 2H2O → Mg(OH)2 + H2.
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2.
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
Zn + H2O → ZnO + H2.
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
С + H2O → CO + H2
Si + 2H2O → SiO2 + 2H2.
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
M2O + H2O → 2MOH или MO + H2O → M(OH)2.
Например:
Na2O + H2O → 2NaOH или CaO + H2O → Ca(OH)2.
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
Примеры амфотерных оксидов: ZnO, BeO, Al2O3, Fe2O3, Cr2O3.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
2NO2
Исключение: SiO2 + H2O → реакция не идет.
Взаимодействие воды с металлами | moiurokihimii.ru
А разве такое возможно — спросите вы? Ведь можно же хранить воду, готовить пищу в металлической посуде, например, алюминиевой. И никаких признаков взаимодействия воды с оцинкованным ведром при мытье пола тоже никто не замечал.
И все же вода взаимодействует со многими металлами. Но реакции эти идут по-разному.
Если металл активный — литий, натрий, калий, кальций, барий, то получается так:
2Na + 2H2O → 2NaOH + H2
Кусочек натрия, попав в воду, быстро бегает по ее поверхности — его подталкивает выделяющийся водород. А в растворе образуется новое вещество — гидроксид натрия NaOH. Внимание: мы впервые встречаемся с веществом, молекула которого содержит группу атомов ОН. Эта группа ОН называется гидроксилом или гидроксогруппой. Вещества же, молекулы которых состоят из атомов металла и одной или нескольких гидроксогрупп, называются основаниями. Таким образом, в реакции натрия с водой образуются газ водород и основание — гидроксид натрия NaOH. Если перед реакцией в воду добавить индикатор фенолфталеин, то вода от гидроксида натрия станет малинового цвета.
Запомним: число групп ОН в молекуле основания всегда равно валентности металла в основании:
KOH NaOH LiOH Mg(OH)2 Fe(OH)2 Fe(OH)3 Al(OH)3
Литий и калий взаимодействуют с водой так же, как и натрий, но у лития эта реакция идет чуть медленнее, а у калия быстрее, чем у натрия. Значит, это металлы разной химической активности.
2Li + 2H2O → 2LiOH + H2
2K + 2H2O → 2KOH + H2
А вот как взаимодействуют с водой двухвалентные активные металлы кальций и барий:
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Вот так взаимодействует с водой алюминий:
Если металл менее активен, то реакция его с водой идет медленнее, незаметнее, чаще при нагревании, и образуются при этом водород и оксид металла, а не гидроксид:
Zn + H2O → ZnO + H2
3Fe + 4H2 → Fe3O4 + 4H2
Если же металл находится в ряду активности правее водорода, то он с водой не реагирует: это медь серебро ртуть, золото, платина.
Еще на эту тему:
Химические свойства воды. 6 основных типов химических реакций для воды.
Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
3Fe + 4H2O = 4H2
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO (при сильном нагревании)
CH4 + 2H2O = 4H2 + CO2 (при сильном нагревании)
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
|
SO2 |
+ |
H2O |
= |
H2SO3 |
сернистая кислота |
|
SO3 |
+ |
H2O |
= |
H2SO4 |
|
серная кислота |
|
CO2 |
+ |
H2O |
= |
H2CO3 |
|
угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
|
CaO |
+ |
H2O |
= |
Ca(OH)2 |
|
гидроксид кальция (гашеная известь) |
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
|
CuSO4 |
+ |
5 H2O |
= |
CuSO4.5H2O |
|
вещество белого цвета (безводный сульфат меди) |
кристаллогидрат (медный купорос),синие кристаллы |
Приведем другие примеры образования гидратов:
H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Фотосинтез . Особая реакция воды– синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
ЕГЭ. Химические свойства металлов
Химические свойства металлов
1. Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
2Li + O2 → 2Li2O
2Na + O2 → Na2O2
Оксиды получают взаимодействием пероксидов с металлом:
Na2O2 + 2Na → 2Na2O
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
3Mg + 2P → Mg3P2 (t)
2Na + Cl2 → 2NaCl
Ca + 2C → CaC2 (t)
5) Реагируют с некоторыми кислотными оксидами:
CO2 + 2Mg → 2MgO + C
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
2Mg + TiCl4 → 2MgCl2 + Ti (t)
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
2Al + 3Cl2 → 2AlCl3
4Al + 3C → Al4C3
2Al + N2 → 2AlN (t)
6) Используется для восстановления менее активных металлов (алюмотермия):
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Al + H2SO4 (р) → Al2(SO4)3 + H2
8) Вытесняет менее активные металлы из их солей:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода.
3. Железо
1) Реагирует с кислородом:
3Fe + 2O2 → Fe3O4 (железная окалина)
В присутствии воды образуется ржавчина:
4Fe + 3O2 + 6H2O  → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
3Fe + 4H2O → Fe3O4 + 4H2 (t)
4) Не реагирует с щелочами
Fe + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe + 3F2 → 2FeF3 (образуется соль Fe+3)
2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe+3)
2Fe + 3Br2 → 2FeBr3 (образуется соль Fe+3)
Fe + I2 → FeI2 (образуется соль Fe+2)
Fe + S → FeS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Fe + H2SO4 (р) → FeSO4 + H2 (образуется соль Fe+2)
Fe + 2HCl → FeCl2 + H2
7) Вытесняет менее активные металлы из их солей:
Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe+2)
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
Fe + 6HNO3(к) → Fe(NO3)3 + 3NO2 + 3H2O (образуется соль Fe+3)
2Fe + 6H2SO4(к) → Fe2(SO4)3 + 3SO2 + 6H2O (образуется соль Fe+3)
9) Соединения Fe+3 реагируют с железом, медью, восстанавливаясь до Fe+2:
2FeCl3 + Fe → 3FeCl2
Fe3O4 + Fe → 4FeO
Fe2O3 + Fe  → 3FeO
4. Хром
1) Реагирует с кислородом:
4Cr + 3O2 → 2Cr2O3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
2Cr + 3H2O → Cr2O3 + 3H2 (t)
4) Не реагирует с щелочами
Cr + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe+3)
2Cr + 3Br2 → 2CrBr3 (образуется соль Fe+3)
Cr + S → Cr2S3 (образуется соль Fe+3)
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr + H2SO4 (р) → CrSO4 + H2 (образуется соль Cr+2)
Cr + 2HCl → CrCl2 + H2 (образуется соль Cr+2)
7) Пассивируется концентрированным и разбавленным растворами азотной кислоты (т.е. реакция не протекает).
5. Медь
1) Реагирует с кислородом:
2Cu + O2 → 2CuO
2) Реагирует с соединениями Cu+2 с образованием промежуточной степени окисления +1:
CuO + Cu → Cu2O
CuCl2 +
Урок 28. Химические свойства воды – HIMI4KA
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.


При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).


При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
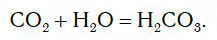
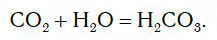
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):


Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
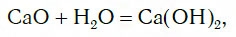
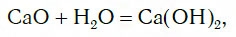
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
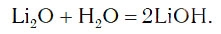
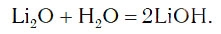
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
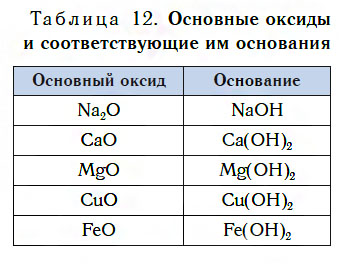

Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
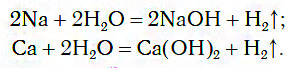
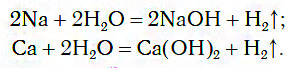
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические свойства простых веществ металлов и неметаллов
Урок посвящен обобщению и систематизации знаний о свойствах простых веществ — металлов и неметаллов. Эти два класса веществ отличаются не только физическими, но и химическими свойствами.
Рассмотрим реакции металлов и неметаллов с кислородом. При взаимодействии простых веществ с кислородом образуются, как правило, оксиды. Причем металлы с кислородом обычно образуют основные оксиды, а неметаллы – кислотные.
|
Металлы |
Неметаллы |
|
1. Взаимодействие с кислородом |
|
|
Как правило, образуются основные оксиды: 2Mg + O2 = 2MgO 3Fe + 2O2 = Fe3O4 |
Как правило, образуются кислотные оксиды: S + O2 = SO2 4P + 5O2 = 2P2O5 |
Вы уже знаете, что вещества могут гореть не только в атмосфере кислорода. Некоторые вещества горят при взаимодействии с хлором. Реакции металлов и неметаллов с хлором приводят к образованию хлоридов.
Металл с хлором образует соединение, относящееся к классу солей.
Хлорид неметалла же солью не является.
|
Металлы |
Неметаллы |
|
2. Взаимодействие с хлором |
|
|
Образуются соли: 2К + Cl2 = 2КCl 2Fe + 3Cl2 = 2FeCl3
|
Образуются вещества, не являющиеся солями: 2P + 3Cl2 = 2PCl3 2P + 5Cl2 = 2PCl5 |
При взаимодействии активных металлов с водородом образуются твердые нелетучие гидриды, а при взаимодействии неметаллов с водородом – летучие водородные соединения.
|
Металлы |
Неметаллы |
|
3. Взаимодействие с водородом |
|
|
Образуются твердые нелетучие гидриды: 2Na + H2 = 2NaH Ca + H2 = CaH2 |
Образуются летучие водородные соединения: Cl2 + H2 = 2HCl С + 2Н2 = СН4 |
Реакции с водой для неметаллов не характерны. Из металлов с водой взаимодействуют только те, которые стоят в ряду активности левее водорода. Причем, самые активные из них (щелочные и щелочноземельные) образуют щелочь и водород. Например, при взаимодействии натрия с водой образуется щелочь (гидроксид натрия) и выделяется водород. Такие реакции сопровождаются выделением большого количества теплоты.
Некоторые металлы взаимодействуют с парами воды с образованием оксида и водорода.
|
Металлы |
Неметаллы |
|
4. Взаимодействие с во |
Химические свойства металлов IIA группы (Be, Mg, Ca, Sr, Ba, Ra).
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
2Mg + O2 = 2MgO
2Ca + O2 = 2CaO
2Ba + O2 = 2BaO
Ba + O2 = BaO2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I2 = MgI2 – иодид магния
Са + Br2 = СаBr2 – бромид кальция
Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:

Остальные металлы II А группы образуют с углеродом ацетилениды:

С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):

с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.

Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:

c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
Ве + Н2SO4(разб.) = BeSO4 + H2↑
Mg + 2HBr = MgBr2 + H2↑
Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:

Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы может происходить до SO2, H2S и S в зависимости от активности металла, температуры проведения реакции и концентрации кислоты:
Mg + H2SO4(конц.) = MgSO4 + SO2↑ + H2O
3Mg + 4H2SO4(конц.) = 3MgSO4 + S↓ + 4H2O
4Ca + 5H2SO4(конц.) = 4CaSO4 +H2S↑ + 4H2O
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:

Метод восстановления металлов из их оксидов магнием называют магниетермией.
