Вода — Википедия
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H2O | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 0,9982 г/см3[2] | ||
| Твёрдость | 1,5[4] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| Удельная теплота испарения | 2256,2 кДж/кг[3] | ||
| Удельная теплота плавления | 332,4 кДж/кг[3] | ||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | ||
| Рег. номер CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| Рег. номер EINECS | |||
| SMILES | |||
| InChI | |||
| RTECS | ZC0110000 | ||
| ChEBI | 15377 | ||
| ChemSpider | 937 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 | |||
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает водаВода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[7], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[8].
Всего на Земле около 1400 млн кубических километров воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн квадратных километров
Происходит от др.-русск. вода, далее от праславянского *voda[13] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем от праиндоевропейского *
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH— и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH—
- Монооксид дигидрогена
Физические свойства[править | править код]
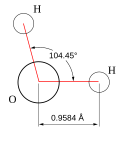
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду).
Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[17].
Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[19]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[23]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править | править код]
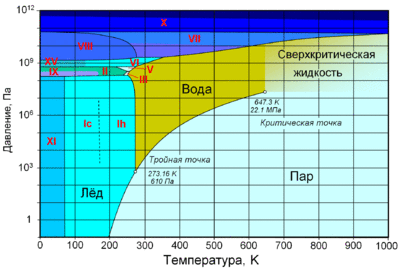
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[24]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства[править | править код]
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации[править | править код]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O17 и H2O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[18].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[18].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править | править код]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- в ходе реакций —
- 2h3O2→2h3O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}\uparrow }}}
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
- 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
- h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
- HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
- 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
- Восстановлением водородом оксидов металлов —
- CuO+h3→Cu+h3O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow Cu+H_{2}O}}}
Под воздействием очень высоких температур или электрического тока (при электролизе)[25], а также под воздействием ионизирующего излучения, как установил в 1902 году[26]Фридрих Гизель[en] при исследовании водного раствора бромида радия[27], вода разлагается на молекулярный кислород и молекулярный водород:
- 2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}
Вода реагирует при комнатной температуре:
- 2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}
- со фтором и межгалоидными соединениями
- 2h3O+2F2→4HF+O2{\displaystyle {\mathsf {2H_{2}O+2F_{2}\rightarrow 4HF+O_{2}}}}
- h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах)
- 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
- 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- Al2S3+6h3O→2Al(OH)3↓+3h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- 4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}
- h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды[править | править код]
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}}
химический состав, польза и вред, отличия от обычной
Дистиллированная вода представляет собой химическое соединение, состоящее из двух атомов водорода и одного атома кислорода. Молекула этого вещества химически обозначается формулой H2O. В результате процесса дистилляции из воды удаляются все примеси и ионы. Особые свойства дистиллированной воды рассматриваются в статье.
Важность воды для человека
В организме человека находится около 65 % воды. Это вещество является более важным для жизни человека, чем пища, поскольку без еды человек может поддерживать свои жизненно важные функции в течение нескольких недель, а без воды жизнь человека заканчивается через несколько дней.

Вода выполняет следующие функции в организме:
- подвод питательных веществ к клеткам и вывод продуктов распада из них;
- помощь в процессе пищеварения, которая заключается в образовании желудочного сока;
- постоянное увлажнение кожи, глаз, рта, носоглотки и суставов;
- регулирование температуры тела и метаболических процессов в организме.
Употребление достаточного количества воды в сутки способствует профилактике следующих состояний:
- диабет;
- гипогликемия;
- артрит;
- сухость кожи;
- ожирение и некоторые другие.
Если человек потеряет 20 % воды своего организма, то наступает немедленная смерть.
Что такое дистиллированная вода, какими физическими свойствами она обладает
Дистиллированная вода представляет собой жидкое вещество, состоящее только из молекул H2O. Получается оно в результате процесса дистилляции, который состоит в разделении жидких компонент в смеси.

Физико-химические свойства дистиллированной воды отличаются от таковых для обычной воды, которую человек пьет ежедневно. Это отличие связано с высокой чистотой дистиллированной воды. Например, если говорить о таком физическом свойстве, как электропроводность, то она является практически нулевой. В дистиллированной воде нет носителей тока, которые в воде обычной представляют собой ионы хлора, кальция, магния и фтора.
Отметим, что сама молекула H2O является электрически нейтральной, поэтому не может участвовать в процессе образования электрического тока. Справедливости ради отметим, что ионное произведение воды, то есть произведение молярных концентраций ионов H+ и OH— составляет 10-14, то есть в одном литре воды существует 10-7 моль атомов каждого из этих ионов. Однако эта концентрация является слишком малой, чтобы создавать практически ощутимый электрический ток.
Следует отметить еще один феномен, который касается такого физического свойства дистиллированной воды, как кипение. Процесс связан с наличием в веществе примесей и различных макроскопических частиц. В случае дистиллированной воды таких частиц нет, поэтому жидкость можно нагреть гораздо выше 100 °C, и она не будет кипеть. Если в такую «перегретую» воду добавить соль или сахар, или же просто начать мешать воду, то она начнет кипеть взрывным образом.
Процесс дистилляции
Этот процесс для очистки воды используется с давних времен. Суть процесса дистилляции методом выпаривания заключается в том, что в герметично закрытом сосуде (дистилляторе) кипит вода, ее пары поднимаются и попадают в специальную емкость, которая называется конденсатором. Здесь вещество снова переходит из газообразной в жидкую фазу в результате охлаждения. Конечным результатом дистилляционного процесса оказывается очищенная от примесей вода в конденсаторе и оставшийся осадок в дистилляторе.

Полученная данным способом жидкость не обладает 100 % чистотой, поскольку в процессе испарения вместе с паром увлекается небольшое количество частиц примеси.
Отметим, что такой метод дистилляции воды будет бесполезен, если в исходной воде присутствуют примеси, которые также при кипении будут переходить в газообразное состояние, например, спирты.
Дистиллированная вода и ее pH
Если говорить о химических свойствах дистиллированной воды, то в первую очередь следует сказать о ее pH. Показатель кислотности pH, или водородный показатель, математически определяется, как отрицательный десятичный логарифм от молярной концентрации катионов водорода. Если значение pH>7, то говорят о щелочной среде, если pH<7, тогда речь идет о кислой среде.
Обычная вода имеет слегка кислую среду, а для дистиллированной же воды pH = 5,8. Причиной такой кислотности чистой воды является то, что в ней растворено большое количество углекислого газа.
Растворяясь в дистиллированной воде, углекислый газ образует карбоновую кислоту по следующей химической реакции: 2H2O + CO2 -> H2O + H2CO3.
В растворе в действительности существуют катион аммония H3O+ и анион гидрокарбоната HCO3—. Процесс насыщения углекислым газом вновь полученной дистиллированной воды, которая имеет pH = 7, происходит за 1-2 часа.
Следует также отметить, что pH ультрачистой воды тяжело измерить, поскольку такое физико-химические свойство дистиллированной воды, как электропроводность, практически равно нулю, что сильно искажает результаты специальных приборов для измерения кислотности — pH-метров.
Бидистиллированная вода
Такая вода получается в результате двойного процесса дистилляции. Такую жидкость часто называют химически чистой. Если результаты измерений чистоты бидистиллированной воды являются неудовлетворительными, то к ней применяют еще раз процесс дистилляции.
Она используется главным образом в качестве растворителя медикаментов для их парентерального введения. Также она применяется для приготовления гипоосмолярных растворов для их внутривенного или внутримышечного введения.
Применение дистиллированной воды
Вода является жизненно важным веществом для человека и для жизни на планете в целом. Ведь она считается универсальным растворителем и используется широко во всех сферах человеческой деятельности. Однако для своего использования вода должна обладать определенным уровнем качества. Процесс дистилляции является одним из способов улучшения качества воды.

Чаще всего дистиллированная вода используется в следующих процессах:
- Непосредственное потребление человеком. Полезные свойства дистиллированной воды заключаются в том, что она не содержит различных вредных примесей в своем составе. В жаркое время года люди пьют эту воду с кубиками льда. Поскольку она не содержит примесей, то температура ее замерзания точно соответствует 0 °C. Отметим, что физико-химические свойства дистиллированной воды после заморозки и последующей ее разморозки сохраняются.
- Химия. Дистиллированную воду используют для работы с различными реактивами в лабораторных условиях.
- Индустрия. Чистая вода используется при производстве охлаждающих напитков, а также в котлах, избегая тем самым образования в них накипи.
- Практически во всех медицинских процессах.

Возможные проблемы при употреблении дистиллированной воды
Дистиллированная вода не содержит примесей, которые присутствуют в обычной воде. Некоторые из этих примесей могут быть полезными, например, анионы фтора, которые специально добавляют в жидкость с целью профилактики кариеса. Поэтому постоянное употребление дистиллированной воды может значительно увеличить риск его образования.

Ионы кальция и магния являются полезными для здоровья человека, поэтому рекомендуется компенсировать их отсутствие в дистиллированной воде употреблением других продуктов питания.
ГОСТ 6709-72 Вода дистиллированная. Технические условия
2.5 Требования к качеству воды и водоподготовке
ГОСТ 6709-72
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВОДА ДИСТИЛЛИРОВАННАЯ
ТЕХНИЧЕСКИЕ УСЛОВИЯ
|
Москва Стандартинформ 2007 |
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
ВОДА ДИСТИЛЛИРОВАННАЯ Технические условия Distilled water. Specifications |
ГОСТ |
Дата введения 01.01.74
Настоящий стандарт распространяется на дистиллированную воду, получаемую в перегонных аппаратах и применяемую для анализа химических реактивов и приготовления растворов реактивов.
Дистиллированная вода представляет собой прозрачную, бесцветную жидкость, не имеющую запаха.
Формула: Н2O.
Молекулярная масса (по международным атомным массам 1971 г.) — 18,01.
(Измененная редакция, Изм. № 1).
1.1. По физико-химическим показателям дистиллированная вода должна соответствовать требованиям и нормам, указанным в таблице.
|
Наименование показателя |
Норма |
Дистиллированная вода – самый чистый химический реактив
Дистиллированная вода – самый чистый химический реактив
Дистиллированная вода – экологически чистая, абсолютно прозрачная,  хорошо очищенная от органических и неорганических примесей вода, без запаха и вкуса. Получают такой химический реактив техническим способом путем перегонки природной воды (превращение ее в пар с последующей конденсацией) благодаря специальному испарительному лабораторному оборудованию – дистиллятору. Как и большинство видов лабораторного оборудования: лабораторные весы, песочные часы, ступка с пестиком, дистиллятор разработаны не только для лабораторного, но и для домашнего пользования.
хорошо очищенная от органических и неорганических примесей вода, без запаха и вкуса. Получают такой химический реактив техническим способом путем перегонки природной воды (превращение ее в пар с последующей конденсацией) благодаря специальному испарительному лабораторному оборудованию – дистиллятору. Как и большинство видов лабораторного оборудования: лабораторные весы, песочные часы, ступка с пестиком, дистиллятор разработаны не только для лабораторного, но и для домашнего пользования.
Дистилляторами оснащены все аптеки и медицинские учреждения – изготовление многих лекарственных препаратов осуществляется на основе дистиллированной воды. В природе по физико-химическим свойствам к такой воде близка талая вода ледяных горных вершин. В отличие от обычной воды температура кипения ее выше, замерзания – ниже.
Полезная и вредная вода для организма
Несмотря на свою идеальную чистоту, все же дистиллированная вода не пригодна для питья. Она не может утолить жажду (восполнить водно-солевой баланс нашего организма) из-за отсутствия в ней солей и микроэлементов. Так, например, в крови присутствует большое количество химических веществ и элементов, которые поступают в организм с водой и пищей. В данном случае очищенная вода может только разводить кровь, понижая в ней уровень полезных элементов. Кроме того, ее потребление может неблагоприятно воздействовать на организм, и прежде всего, это связано с отсутствием в ней жизненно важного микроэлемента – кальция, который является главным источником энергии для нормального функционирования сердечнососудистой системы, а отсутствие многих солей – к дисбалансу обмена веществ в организме. Для нормализации ситуации – нужна золотая середина. Это значит, что вода должна быть качественной с определенным количеством полезных веществ. Их избыток (минеральная вода) в больших количествах может оказать такой же вред организму.
Дистиллированная вода в фармацевтике
 При производстве лекарственных препаратов главными составляющими являются лабораторное оборудование и приборы, лабораторная посуда из стекла или других материалов и химические реактивы. Выбор посуды и оборудования зависит от лабораторного процесса, химреактива – от состава лекарства. Неизменным условием является использование в фармацевтической практике дистиллированной воды, так как только ее состав является безвредным для осуществления многих химических реакций. Отсутствие в ней солей и микроэлементов позволяет без риска применять ее в фармакологии: она не способна вступать в реакцию с другими реактивами, что очень важно для чистоты химпроцессов. Кроме того, отсутствие органических примесей не допускает развитие в ней болезнетворных микроорганизмов.
При производстве лекарственных препаратов главными составляющими являются лабораторное оборудование и приборы, лабораторная посуда из стекла или других материалов и химические реактивы. Выбор посуды и оборудования зависит от лабораторного процесса, химреактива – от состава лекарства. Неизменным условием является использование в фармацевтической практике дистиллированной воды, так как только ее состав является безвредным для осуществления многих химических реакций. Отсутствие в ней солей и микроэлементов позволяет без риска применять ее в фармакологии: она не способна вступать в реакцию с другими реактивами, что очень важно для чистоты химпроцессов. Кроме того, отсутствие органических примесей не допускает развитие в ней болезнетворных микроорганизмов.
Дистиллированная вода может быть использована в качестве инъекционного раствора, для этого она проходит вторичную перегонку. Такую воду называют апирогенной.
Важную роль очищенная вода играет при стерилизации лабораторной посуды после обработки ее химическим методом (растворами минеральных кислот или другими моющими средствами): на завершающем этапе ею несколько раз споласкивают.
Способы контроля качества
Для испытания воды на реакцию в нее добавляют несколько капель синтетического анилинового красителя в качестве кислотно-основного индикатора: дистиллированная вода, как нейтральная, окрашивается в желтый цвет, с добавлением хлороводородной кислоты – в розовый.
С целью выявления содержания солей небольшое количество воды выпаривают. Показатель чистоты воды – отсутствие сухих остатков на лабораторной посуде.
Правила хранения воды
Данный химический реактив рекомендуется хранить только в закрытой лабораторной посуде, наполненной доверху. Во избежание попадания диоксида углерода посуду закупоривают пробками, снабженными хлоркальциевой трубкой, заполненной известью и прикрывают ватой для предохранения от воды. Срок хранения для медицинских целей – не более 3 дней, для других – неограниченно.
«ПраймКемикалсГрупп» — качественные химические реактивы по приемлемой цене! 
Пропиленгликоль купить, молочную кислоту купить, дистиллированную воду и хлорное железо купить в Москве выгодно в специализированном магазине химических реактивов Москва розница и опт. На нашем сайте представлен большой ассортимент резинотехнических изделий, а также посуды, приборов из лабораторного стекла. Весь товар прошел контроль качества на заводе-изготовителе, соответствует ГОСТ стандартам и доставляется как по городу, так и по всему Московскому региону.
Prime Chemicals Group – профессиональное оснащение Вашей лаборатории!
Дистиллированная вода. Можно ли пить дистиллированную воду?
Роль воды в жизни человека, как, впрочем, и всего живого на земле, переоценить крайне сложно. С незапамятных времён люди верили в её мистические способности, наделяя даром «живую» и всячески избегая «мёртвую» воду. Да и сегодня исследователи не перестают удивлять новыми открытиями относительно потрясающих свойств этой природной жидкости. Каждый ребёнок со школьной скамьи усвоил прописные истины о том, что организм на 70% (цифра весьма обобщенная, но всё же недалека от реальности) состоит из воды, и столько же процентов всей площади планеты покрыто этой субстанцией. Так в чём же кроется основная загадка воды, какая роль ей отведена в жизнедеятельности человека? Давайте приоткроем завесу тайны.
Для чего нужна вода? Немного природоведения
Ещё среди наших бабушек бытовала поговорка: «Вода всему госпожа: даже огонь воды боится». И действительно, сложно представить хотя бы один день, проведённый без жидкости. Даже пища не играет столь важной роли в поддержании жизни: без еды физически здоровый человек может обходиться 30-40 дней, а недостаток воды уже на третьи сутки приведёт к определённым процессам, затрагивающим все органы и ткани. Почему так происходит? Ответ лежит на поверхности: функции воды или, как её принято называть в среде химиков, оксида водорода, затрагивают любой процесс, протекающий в организме:
- Многие витамины, аминокислоты и минеральные вещества, необходимые человеку, являются водорастворимыми, а значит, без требуемого количества жидкости попросту не могут усвоиться.
- Пищеварение без жидкости не будет полноценным (именно поэтому в рацион включают не только 2-3 литра воды, но и горячий супчик на обед).
- Доставка полученных организмом питательных веществ и кислорода осуществляется посредством воды.
- Саморегуляция невозможна без жидкости: она выводит продукты жизнедеятельности, помогает очиститься от токсинов, участвует в терморегуляции и других жизненно важных процессах.
- Мышечный каркас попросту увянет и перестанет сокращаться, если не обеспечить должный баланс влаги в клетках.
- Суставы не смогут функционировать в полном объёме, поскольку жидкость является своеобразным амортизатором движения.
- Даже небольшое обезвоживание снижает активность мозговой деятельности.

Это лишь основные функции воды в организме – перечислять все причины её важности для поддержания здоровья можно бесконечно. Правда, большую роль играет и качество употребляемой жидкости: едва ли принесёт пользу напиток, начинённый красителями и вредными веществами, которых сейчас в избытке даже в простой бутилированной воде, не говоря уже о её водопроводном собрате. Именно поэтому многие стали задумываться над тем, какую воду лучше употреблять, чтобы очистить организм от пагубных элементов и поддержать его полноценную работу.
Дистиллированная вода: основные особенности
С дистиллированной водой связано много вопросов и слухов, поскольку даже в научных кругах до сих пор не пришли к единому мнению относительно её пользы и потенциального вреда для человека. Это связано с тем, что стереотипы вокруг понятия «дистиллят» укоренились достаточно прочно: едва ли у простого обывателя, привыкшего верить рекламе, чистая вода ассоциируется именно с этим понятием. Тем не менее, именно этим и является жидкость с чисто техническим названием.
Сложный на первый взгляд химический термин «дистиллят» (или «дистиллированная вода») имеет вполне простое и понятное толкование. Так называют воду, прошедшую процесс очистки от посторонних примесей методом дистилляции, или разделения на отличные по составу компоненты. Проще всего этот процесс представить на примере испаряющейся во время кипячения жидкости, которая оседает небольшими каплями на любой твёрдой поверхности – крышке кастрюли, потолке и любом другом предмете, куда попадает пар. Эти капли и являются примером дистиллированной воды.

В такой жидкости полностью отсутствуют какие-либо примеси (как вредные, так и полезные). По сути, это обычный конденсат, чистота которого объясняется разными температурами испарения либо молекулярными массами воды и содержащихся в ней примесей. Для её производства используют специальные установки – аквадистилляторы. Впрочем, для личного пользования такой объём не требуется, поскольку секрет о том, как сделать дистиллированную воду в домашних условиях, давно раскрыт.
В природе существует множество примеров естественной дистилляции. Взять хотя бы дождевую воду: из испарений влаги с поверхности земли образуются облака, которые, постепенно разрастаясь, выпадают обратно на землю проливным дождём дистиллированной воды. Правда, в последние десятилетия туда стали примешиваться азотная и серная кислота – экологические проблемы дают о себе знать, – но суть остаётся прежней. Роса, талый снег и капли влаги на плёнке парников, знакомые каждому дачнику – всё та же дистиллированная вода. Иными словами, всё то, что сначала испарилось, а затем осело в виде жидкости, и есть дистиллят. Поэтому её и относят к самой чистой жидкости, которую можно получить наиболее естественно – смена агрегатных состояний попросту не оставляет возможности примесям сохраниться в её составе.
Сфера использования дистиллированной воды
Зная физические и химические свойства дистиллированной воды, несложно предположить, что её первостепенное использование относится к технической, научной и медицинской сферам. Чаще всего дистиллят применяется в следующих областях:

- Дистиллированная вода занимает одно из ведущих мест в фармакологии, поскольку используется для растворения множества лекарственных препаратов.
- Поскольку примеси, содержащиеся в обычной проточной воде, могут влиять на протекание электрохимических реакций, серную кислоту для заправки автомобильных аккумуляторов разбавляют дистиллированной. Кроме того, автомобилисты используют очищенную воду для разведения концентрированного антифриза и стеклоомывателя.
- Если заправлять системы кондиционирования, парооочистители, увлажнители воздуха и даже банальные утюги с парогенератором водопроводной водой, известковые отложения не заставят себя ждать, и вскоре оборудование выйдет из строя. Чтобы этого не произошло, необходимо использовать дистиллят.
- Очищенная от примесей вода используется в современных отопительных системах. Поскольку она не содержит осадков, в системе отсутствуют перепады давления, а значит, не нарушается равномерная циркуляция.
- Многие лабораторные измерительные приборы, нуждающиеся в очистке после эксплуатации, помещаются в дистиллированную воду – согласно регламенту, такой подход позволяет продлить срок их службы и сохранить точность. Также дистиллят используется для калибровки медицинских измерительных приборов, поскольку динамичный состав водопроводной воды может существенно отразиться на степени погрешности показателей.
Кроме того, многие медицинские светила рекомендуют использовать дистиллированную воду для очищения организма от токсинов и шлаков, особенно после сильных пищевых отравлений и интоксикации иного генеза. Правда, перед этим она проходит микроструктуризацию – замораживание и повторное размораживание для изменения структуры химических соединений. Полученная жидкость способствует насыщению клеток органов и тканей питательными веществами, которые поступают извне, а также улучшает восприимчивость к минеральным элементам.

Можно ли пить дистиллированную воду? Две стороны одной медали
Споры о том, можно ли использовать дистиллированную воду для питья и приготовления пищи, не смолкают по сей день. Одни с категоричностью, не терпящей возражений, отстаивают вредность дистиллята для организма, приводя, на первый взгляд, научно обоснованные и логичные доводы, которые при детальном рассмотрении оказываются не такими уж бесспорными. А другие на своём примере доказывают, что пить дистиллированную воду не только можно, но и нужно. Впрочем, не нужно верить ни тем, ни другим на слово: выслушав аргументы обеих сторон, необходимо принять самостоятельное решение, ведь за своё здоровье человек отвечает сам.
Аргументы «Против»
Среди медицинских работников бытует мнение, что дистиллят является так называемой «мёртвой» водой, которая крайне губительна для всего живого. Объясняется такой подход достаточно легко: в ней нет никаких микроэлементов, которые могли бы быть полезны для организма, один лишь чистый Н2О. К тому же, в качестве питьевой её стали использовать лишь после того, как она зарекомендовала себя в фармакологической среде – по сей день весомая доля лекарств разбавляется именно дистиллятом. Бытует мнение, что очищенная вода способна разжижать кровь и вымывать из организма магний, калий и кальций, а значит, разрушать зубы и кости, негативно отражаться на работе сердца и эластичности сосудов. Откуда же берёт начало эта позиция? Давайте разбираться.
Из базового курса биологии доподлинно известно, что с потом человек теряет некоторое количество солей, поэтому, если не восполнять дефицит этих компонентов с помощью калийной, морской или, в крайнем случае, поваренной соли, в организме возникнет дисбаланс, который в жаркую погоду может стать катализатором теплового удара. К тому же, чувство жажды заставляет увеличить количество потребляемой жидкости, а вместе с ней растёт и объём выделяемого пота. Поскольку обычная питьевая вода содержит некоторый процент солей, она способна частично восполнять полученный дефицит, в отличие от дистиллированной. Правда, банальное подсаливание дистиллята способно решить эту проблему в разы эффективнее. А вымывать что-либо из организма ни та, ни другая не могут априори.

Другим аргументом против использования дистиллята для питья является его технический характер. Стереотип о том, что очищенную воду можно поставить в один ряд с антифризом, керосином и другими техническими жидкостями, которые никто не пьёт, в корне не верен: даже наши предки доказали, что можно пить дистиллированную воду без вреда для здоровья. Ведь талая или дождевая вода по сути тоже является дистиллятом? А морской флот, долгие месяцы проводящий в подводных лодках? Разве они берут с собой запасы водопроводной воды? Всё, что им нужно для получения питьевой жидкости – аппарат для дистилляции. И никто не жалуется на здоровье!
Пожалуй, самым «знатным» аргументом является следующее утверждение, которое практически дословно копируют множество псевдонаучных сайтов: «Дистиллированная вода — мономолекулят, обладающий повышенной агрессивностью. Если её выпить, то попадая в организм, она легко преодолевает мембранные перегородки клеток и нарушает состав клеточного сока в клетках, что нарушает их функционирование» (с). Правда, ни один учебник химии, равно как и всезнающая Википедия и другие интернет-ресурсы не смогли объяснить, что такое «мономолекулят». Зато звучит красиво и убедительно!
Аргументы «За»
Дистиллированная вода является самой чистой на земле жидкостью, которую только можно вообразить. Да, она не содержит минеральных веществ, однако токсинов, шлаков и прочих убийственных для человека компонентов в ней тоже не встретишь. И если нельзя пить дистиллят, что тогда можно?

- Химический состав водопроводной воды в современном городе может включать всю таблицу Менделеева, причём далеко не в самых полезных сочетаниях.
- Колодцы и родники, которые ещё несколько десятилетий назад могли обеспечить кристально чистой жидкостью, пригодной для питья, сегодня безнадежно испорчены пестицидами, гербицидами и другими ядами, которые «подарило» земле сельское хозяйство.
- Бутилированная якобы питьевая вода ничуть не менее опасна, чем её водопроводный прообраз – согласно данным независимых исследований, в её также присутствуют бактерии, металлы и органические примеси, которые к тому же в некоторых случаях дополняются фармпрепаратами.
- Про магазинные соки и напитки даже говорить не стоит: их состав пестрит красителями, консервантами, сахарами и прочими пагубными для здоровья компонентами. Взять, к примеру, столь любимую подростками «Кока-Колу»: ортофосфорная кислота, входящая в её состав, широко применяется в стоматологии для снятия эмали с зубов. И её предлагают пить?
- Свежевыжатые соки, несомненно, крайне полезны, вот только пить их в большом количестве не рекомендуется, поскольку это может отразиться на кислотности в ЖКТ. Да и приготовить обед, используя фреш, едва ли получится.
Так что вопрос о том, можно ли пить дистиллированную воду, стоит отнести к разряду риторических: очищенную от примесей и посторонних компонентов жидкость использовать для питья не только можно, но и нужно. Она помогает растворять и выводить токсины, которые годами копятся в организме представителя современного общества, не оставляя при этом ни малейшего осадка в виде неорганического песка в почках. Кроме того, отсутствие минералов обеспечивает мягкость дистиллята, которая способствует лучшей работе желудочно-кишечного тракта и мочевыделительной системы. Чтобы убедиться в её целебных свойствах наглядно, достаточно вымыть дистиллированной водой волосы – такого блеска и податливости сложно добиться даже умелому парикмахеру.

Что касается специфического вкуса дистиллированной воды, который многим кажется неприятным, это не более чем субъективное заблуждение. Вода, лишённая примесей, вообще не имеет никакого вкуса – те или иные нотки привносили минералы и другие элементы, а, лишившись их, жидкость потеряла какие бы то ни было оттенки вкуса. Поэтому всё, что кажется неприятным при питье дистиллята – не более чем непривычные ощущения от чистоты воды. А приготовив с её помощью блюда, можно, наконец, насладиться истинным вкусом самих продуктов, не замутненным примесями непонятного происхождения.
Как сделать дистиллированную воду в домашних условиях?
Чтобы получить дистиллят для домашнего использования, совсем не обязательно покупать сложные установки или штудировать множество технической литературы, ведь существует немало простых и эффективных способов, которые не потребуют много времени. Поскольку дистилляция происходит при изменении агрегатного состояния воды, достаточно обеспечить ей необходимую разницу температур – и процесс очистки пройдёт успешно.
Стоит отметить, что перед изготовлением домашнего дистиллята следует подготовить воду к очистке. Для этого необходимо всего лишь дать ей отстояться в течение 6-8 часов, после чего аккуратно слить в другую ёмкость верхний слой (примерно 2/3 от общего объёма) либо удалить с помощью трубочки нижнюю треть. Поскольку молекулярная масса примесей выше, чем у оксида водорода, за это время они осядут в нижний слой воды, который впоследствии не используется для дистилляции из-за высокого содержания минералов и других компонентов. Ну а дальше можно действовать на своё усмотрение, нагревая либо охлаждая воду для дальнейшей очистки. Взяв на заметку один из предложенных способов, можно получить столько жидкости, сколько необходимо в ежедневном рационе.

Как получить дистиллированную воду?
Выпаривание
Этот способ основан на длительном кипячении подготовленной воды, которая будет постепенно превращаться в пар. Чтобы продистиллировать воду с помощью высоких температур, следует перелить её в кастрюлю (желательно использовать эмалированные вариации), наполнив примерно до половины. Затем в воду следует поместить подставку-решётку (наподобие той, что используется во фритюрнице), поставив на неё чашку для сбора дистиллированной воды.
Как только жидкость начнёт закипать, следует закрыть кастрюлю, положив крышку выпуклой стороной внутрь, чтобы осевший на ней пар стекал к центру и капал в чашку. А ускорить этот процесс поможет любой холодный предмет (например, пакет со льдом или кружка с ледяной водой), положенный поверх крышки – это увеличит контраст между температурами внутри и снаружи кастрюли, а значит, конденсация будет проходить эффективнее. Для очистки 2-3 литров воды с помощью выпаривания не потребуется много времени, зато в мисочке будет ждать абсолютно чистый дистиллят.
Как дистиллировать воду в домашних условиях с помощью замораживания?
Для очистки воды от посторонних примесей с помощью замораживания, потребуется пластиковая бутылка или банка нужного объёма. Заполнив её подготовленной водой, нужно просто поместить ёмкость в морозильную камеру до частичного замерзания. Когда примерно половина воды заледенеет, необходимо вылить жидкие остатки – именно в них сосредоточена большая часть солей и химикатов. После этого следует растопить лёд при комнатной температуре. Талая вода, полученная таким путём, и будет дистиллятом.
Полученная с помощью замораживания дистиллированная вода в домашних условиях хранится достаточно долго, однако пополнять запасы рекомендуется ежедневно, тем более что времени для этого требуется не так уж много (в основном продолжительность заморозки зависит от объёма тары и мощности морозильной камеры). Особенно удобно очищать таким образом воду в зимнее время, когда столбик термометра опускается ниже нуля. Оставив бутылки на улице или на балконе, можно приготовить дистиллят, не беспокоясь о свободном месте в морозильнике.

Метод для ленивых
Одним из великих чудес матушки-природы является возможность самоочищения. Вода, испарившаяся под воздействием солнечных лучей, собирается в облаках, откуда и выпадает вновь в виде дождя, который уже очистился от вредных примесей после преобразования в парообразное состояние и обратно. Всё, что нужно, чтобы получить дистиллят таким образом – подставить миску под крупные капли кристально чистой воды, падающей с небес во время дождя.
А если на улице лежит снег, можно поместить его в кастрюльку и растопить при комнатной температуре – получится та же дистиллированная вода. Естественно, этот метод актуален при условии, что снег лежал где-нибудь в лесу или хотя бы в деревне, на экологически чистой земле, а не на магистрали шумного и загазованного города. Конечно, запастись впрок большим объёмом жидкости таким образом не получится, но для утоления жажды (а при удачном раскладе и для приготовления пищи) полученной воды будет вполне достаточно.
Заключение
Какую жидкость пить – каждый решает самостоятельно. Можно и дальше употреблять водопроводную воду или пакетированный псевдо-сок, превращая свой организм в свалку токсинов и пестицидов, а можно потратить немного времени, чтобы получить чистую воду, лишённую вредных примесей. Да, её химический состав будет чуточку беднее родниковой воды, правда, она уже и в природе-то практически не существует – человек собственными руками уничтожил этот природный дар, загрязняя землю химикатами. Впрочем, эту небольшую дисгармонию солей сложно ощутить, поскольку она с лихвой восполняется правильным питанием и растительной пищей. Зато очищенная от вредных компонентов жидкость не принесет организму ненужных хворей, сохранит работу органов и систем, поможет очиститься от токсинов и шлаков.
Такие понятия как правильное питание и здоровый образ жизни бессмысленны при отсутствии безопасной и чистой воды. Можно сколько угодно высчитывать баланс микроэлементов в рационе, соблюдать диеты и скрупулезно следить за состоянием здоровья, но если при этом пить воду из-под крана, все будет бессмысленно – организм рано или поздно даст сбой. Беспокоясь о качестве воды сегодня, завтра не придется думать о том, как излечиться от недугов!

«Дистиллированная вода» — Яндекс.Знатоки
Существует несколько способов очищения воды и получения дистиллированной воды в домашних условиях. Без применения фильтров, очистителей различных форм и фирм можно добиться того, что вода будет не просто очищена, но и будет обладать даже целебными свойствами. Дистиллированная вода не обладает полезными свойствами, она не содержит солей и примесей вообще, поэтому при длительном употреблении этой воды, происходит вымывание солей из организма.
Приготовление к дистилляции. Очищение воды — отстаивание.
Для начала воду нужно набрать в емкости, например в трехлитровые бутыли и оставить, не накрывая крышками, чтобы она отстоялась несколько часов. В идеале — сутки. Есть и временные рамки — 1-2 часа, чтобы улетучились хлор, сероводород, 6 часов — чтобы осели вредные примеси и соли тяжелых металлов. После этого через трубочку, которую опустите на дно бутыли, необходимо отцедить треть воды из сосуда — в этой воде будут осевшие соли, вредные вещества из воды.
Получение дистиллированной воды в домашних условиях выпариванием.
Дистиллированную воду можно получить путем охлаждения пара. Для этого необходима кастрюля с отстоянной водой, которую ставят на газ и кипятят. Берется емкость поменьше, ставится внутрь кастрюли. После этого большая кастрюля закрывается крышкой. Вода кипит и испаряется, собираясь на крышке, а с крышки уже чистая-дистиллированная вода капает в меньшую емкость.
Метод очищения воды замораживанием.
Очистить воду можно, используя частичное замораживание. Этот способ известен давно, так получали питьевую воду даже из соленой воды. Здесь используется простое правило химии — вода с примесями солей замерзает позже, чем чистая вода. Вы наполняете доверху емкость — банку, пластиковую бутылку и ставите ее в морозильную камеру. Когда в лед превратится треть или половина имеющейся воды, вылейте ту воду, которая не успела замерзнуть. Эта вода с солями и примесями, а чистая осталась в бутылке. Дайте льду растаять при комнатной температуре и пейте очищенную воду. Талая вода также обладает целебными свойствами, т. к. при низких температурах меняется структура воды. Если даже выпить в жару такой воды, то вы не простудитесь.
химический состав, приготовление своими руками и сроки годности
 Дистиллированная вода — это жидкость, из которой удалены все примеси и посторонние вещества. Она получается из обычной путём перегонки. Используется в промышленности, фармакологии, находит применение и в быту. Получают дистиллят в специальных приборах дистилляторах. Химическая формула дистиллированной воды h3O. Существуют простые методы получить дистиллированную воду в домашних условиях.
Дистиллированная вода — это жидкость, из которой удалены все примеси и посторонние вещества. Она получается из обычной путём перегонки. Используется в промышленности, фармакологии, находит применение и в быту. Получают дистиллят в специальных приборах дистилляторах. Химическая формула дистиллированной воды h3O. Существуют простые методы получить дистиллированную воду в домашних условиях.
Получение дистиллята выпариванием
 Чтобы не задаваться вопросом, где взять дистиллированную воду, проще изготовить её своими руками. Для дистилляции надо налить водопроводную воду в какую-нибудь ёмкость и оставить отстаиваться на 6 часов. Ёмкость оставляют открытой. Это делается, чтобы испарились хлор и сероводород. Надо следить, чтобы в ёмкость не попадали пыль и грязь. Передвигать ёмкость нельзя.
Чтобы не задаваться вопросом, где взять дистиллированную воду, проще изготовить её своими руками. Для дистилляции надо налить водопроводную воду в какую-нибудь ёмкость и оставить отстаиваться на 6 часов. Ёмкость оставляют открытой. Это делается, чтобы испарились хлор и сероводород. Надо следить, чтобы в ёмкость не попадали пыль и грязь. Передвигать ёмкость нельзя.
После окончания периода отстаивания нужно погрузить в ёмкость стерилизованную трубку так, чтобы она доставала до дна. Со дна требуется откачать примерно 1/3 объёма жидкости, которая содержит соли тяжёлых металлов и другие примеси. Подготовленную таким образом жидкость можно подвергать выпариванию с целью получения дистиллята.

При подготовке к выпариванию надо выбрать эмалированную кастрюлю с куполообразной крышкой, решётку от газовой плиты и стеклянную чашу для сбора конденсата. Порядок действий:
 Кастрюлю заполняют отстоявшейся жидкостью до половины и ставят на огонь.
Кастрюлю заполняют отстоявшейся жидкостью до половины и ставят на огонь.- На дно кастрюли кладут круглую решётку от газовой плиты и ставят глубокую стеклянную чашу. Она должна находиться на плаву.
- После закипания кастрюлю закрывают перевёрнутой куполообразной крышкой или миской так, чтобы конденсат стекал вниз в стеклянную посуду. Кипяток не должен попадать в чашу с конденсатом.
- На крышку кастрюли или в миску сверху кладут пакет со льдом для ускорения процесса конденсации.
- Конденсат собирается в стеклянной чаше.
Существуют и другие способы сделать дистиллированную воду выпариванием. Ещё один простой метод с использованием двух бутылей. Одна из них должна быть с искривлённым горлом.
Если такой не найдётся, то можно заменить двумя обычными бутылями, и скрепить их шлангом. Для получения конденсата проводят следующие операции:
- Стерилизуют бутыли.
- Бутыль с искривлённым горлом наполовину заполняют отстоявшейся жидкостью.
- Соединяют, примотав их друг к другу.
- Помещают бутыль с искривлённым горлом в ёмкость с кипятком и наклоняют под углом, равным 30°.
- К пустой бутыли прикладывают упаковку льда. Ёмкость подогревается и конденсат поступает в охлаждённую бутыль.
Можно получить дистиллят и с помощью чайника и двух кастрюль разного объёма. Процесс выпаривания:
- Большую кастрюлю нужно чисто вымыть.
- Чайник заполняют отстоявшейся водой и ставят его на плиту.
- Рядом ставят одну на другую кастрюли.
- Верхняя, большего размера, заполняется холодной водопроводной водой.
- Пар из носика чайника должен быть направлен на верхнюю кастрюлю.
Конденсат, образовавшийся на боку верхней кастрюли, будет стекать в нижнюю. Температура кипения дистиллята 100 °C.
Дождевая влага
 Дождевая влага — это природный дистиллят. Её можно собирать в чистые ёмкости и использовать для полива, мытья посуды, умывания и других хозяйственных нужд. Делать это надо подальше от городов, заводов и трасс, которые сильно загрязняют воздух. Осадки, выпавшие в таких местах, могут отличаться большим количеством вредных примесей.
Дождевая влага — это природный дистиллят. Её можно собирать в чистые ёмкости и использовать для полива, мытья посуды, умывания и других хозяйственных нужд. Делать это надо подальше от городов, заводов и трасс, которые сильно загрязняют воздух. Осадки, выпавшие в таких местах, могут отличаться большим количеством вредных примесей.
В первое время после начала ливня вода может быть сильно загрязнена находящимися в воздухе химическими соединениями. Далее воздух будет очищаться, и загрязнения станут меньше. Пить дождевую влагу без очистки не рекомендуется. Неизвестно, какие примеси могут в ней содержаться.
Процесс замораживания
Для этого процесса требуется стеклянная или пластиковая тара. Можно использовать металлическую посуду. В тару заливается отстоявшаяся вода и посуда помещается в морозильную камеру. Когда замерзание достигнет половины объёма, тару нужно достать из морозилки и оставшуюся жидкость слить. Она содержит вредные примеси и соли. Когда оставшийся лёд растает, то тара будет содержать очищенную воду.

Она безвкусная, но выпить её можно. А пить дистиллированную воду из автомагазина — нельзя. Она предназначена для технических целей и поставляется в таре, не предназначенной для хранения пищевых продуктов. Её можно доливать в аккумулятор. Дистиллят имеет слабокислую среду, pH в норме составляет 5,4—6,6.
Дистиллят, приготовленный для фармацевтической промышленности, имеет срок годности трое суток. Для других целей срок годности неограничен.
Почему нельзя пить дистиллированную воду — это вопрос спорный. Она очищена от всяких примесей и в небольших количествах нанести вред не может, но и пользы от неё не будет. Опасно длительное употребление, которое нарушает водно-солевой баланс. В дистилляте отсутствуют полезные для человека свойства, соли и минералы, содержащиеся в обычном питье.

 (
(
 Кастрюлю заполняют отстоявшейся жидкостью до половины и ставят на огонь.
Кастрюлю заполняют отстоявшейся жидкостью до половины и ставят на огонь.