Марганец в воде что это такое
Абсолютно все химические элементы, занесенные в таблицу Менделеева, встречаются в природе, одни редко, а другие относятся к распространенным. Одним из таких является Марганец. Соединения этого элемента находятся на четырнадцатом месте по распространению в окружающей нас природе, а его содержание в земле составляет 0,1 мас. %.
В периодической системе Д. И. Менделеева марганец расположен в побочной подгруппе VII группы четвертого периода и относится к переходным элементам, проявляя положительные степени окисления. Атомный номер элемента — 25. В составе формул химических соединений читается как «марганец».
В быту всем известен перманганат калия («марганцовка») — тёмно-фиолетовые с отблеском черного кристаллы, которые в воде образуют раствор, имеющий ярко выраженный цвет фуксии.
История открытия марганца
Свое название и известность марганец приобрел благодаря шведскому химику Карлу Вильгельму Шееле, который в 1774 году установил, что в пиролюзите содержится марганец. Химик Юхан Готлиб Ган скатывал из образцов пиролюзита шарики и, добавляя в них масло, нагревал в тигле с древесным углем. В итоге получались металлические шарики, вес которых был вдвое меньше изначального. Шееле не удалось выделить элементарный марганец в чистом виде, поэтому в своих трудах он указывал, что в минерале содержится новый элемент.
Первое время металл носил название «магнезия», впоследствии в 1787 году он был переименован в «магнезиум». Однако и это название пришлось изменить, потому что в 1808 г. Хэмфри Дэви открыл химический элемент «магний», который также назвал «магнезиум».
В кругу российских ученых элемент долгое время носил название «пиролюзит», а благодаря А. И. Шереру в 1807 году металл, полученный из пиролюзита, назвали «марганец», а сам минерал носил название «черный марганец».
Химические и физические свойства марганца
Электроотрицательность марганца позволяет элементу проявлять свойства металлов и неметаллов. Так, в соединениях, в состав которых входит МnII, марганец проявляет основные свойства, в соединениях с МnIII и Мn IV — амфотерные свойства, МnVI и МnVII — кислотные свойства.
При нагревании до 450ºС элементарный марганец сгорает в кислороде воздуха, образуя оксид MnO2, который при последующем прогреве до 800ºС превращается в оксид Mn2O3.
В порошковом мелкодисперсном состоянии марганец проявляет большую склонность к вступлению в химические реакции.
Марганец в воде относится к металлам, и имеет пять аллотропных модификаций: с кубической и с тетрагональной кристаллическими решетками. В качестве простого вещества представлен в виде твердого, но хрупкого металла серебристо-белого цвета с плотностью 7,2 г/см3. На воздухе покрывается оксидной пленкой с пестрыми пятнами. Марганец способен проводить электрический ток. Температура его плавления составляет 1245°С, при дальнейшем нагреве до 2120°С закипает.
Применение марганца
Высокое распространение соединений марганца позволяет использовать его в трех основных направлениях:
- промышленное;
- бытовое;
- биологическое.
В промышленности марганец используется как легирующий металл для придания сплавам коррозинностойкости, твердости, а также для получения солей.
В быту марганец применяется в виде раствора солей перманганата калия в качестве средства с антисептическими действиями для обработки кожи, слизистых оболочек, а также при посадке растений и обработке почвы.
Биологическое назначение марганца не менее важное. Он входит в десятку самых важных микроэлементов для нормального функционирования животных организмов и растений. Соединения марганца участвуют в образовании белковых комплексов, аминокислот и ферментов, в гидролизе АТФ и активации нуклеазы. При его недостаточном количестве снижается усвоение витамина В1, и появляется риск развития диабета.
Переизбыток соединений марганца в организме оказывает негативное влияние, в первую очередь, на нервную систему. Снижение интеллектуальной способности, головокружения, судороги и боли в спине, отравления — это лишь малый перечень последствий накоплений марганца в костях, почках, кишечнике.
Откуда марганец в воде
При проверке водопроводной воды или воды из скважины в составе не редко можно обнаружить марганец. Но что такое марганец в воде из скважины? Можно ли пить эту воду? Без риска для здоровья допустимая норма потребления марганца в сутки (по ГОСТу):
- Норма марганца в воде для взрослого — до 5 мг;
- Содержание марганца в питьевой воде для подростков — 2 мг;
- Норма по марганцу в воде для детей в возрасте до 1 года — 1 мг.
Содержание марганца в воде из скважины или колодца зависит от сезона, например, зимой из-за застоя воды его скапливается больше, от температуры, PH и объема техногенного загрязнения воды.
ВОЗ установил пдк по марганцу в питьевой воде — содержание элемента не должно быть более 0,05 мг/л. Однако в России был установлена иная норма содержания марганца в воде: в централизованных системах до 0,1 мг/л, в скважинах, родниках и иных открытых источниках — не более 0,5 мг/л. Для питьевой и технической воды нормы марганца не отличаются.
Как проверить воду на марганец
Определить марганец в воде, не имея специальных анализаторов, сложно. Есть несколько признаков марганца в воде, которые дают повод задуматься, о необходимости проведения анализа:
- если в воде присутствует железо, то марганец в ней тоже есть;
- при повышенной концентрации соединений марганца вода темнеет и мутнеет;
- остается черный налет на посуде после кипячения;
- при повышенном содержании марганца в воде присутствуют неприятный запах и вяжущий вкус;
- образуется темный налет на трубах вплоть до засорения.
- Санитарные станции и частные лаборатории проводят количественный анализ проб воды и предоставляют результаты в течение недели. Одним из методов определения содержания марганца в воде является фотометрическое определение марганца в воде.
Чем вреден марганец в воде
Как влияет марганец в воде на человека? Без сомнения превышение допустимых концентраций марганца опасно для здоровья, поэтому важно ответственно относиться к водоподготовке, в частности, к очистке воды. Чаще всего минерал находится в виде двухвалентного иона, который легко растворяется в воде. Действия очистных фильтров основываются на связывании свободных ионов и переводе их в твердодисперсные нерастворимые формы, которые в виде осадка удерживаются в фильтрующих устройствах. Подробнее о том, как очистить воду от марганца из скважины, колодца или водопровода можно прочитать в статье «Как очистить воду от марганца».
Фильтр для железа и марганца в воде
Ткани человека в зависимости от возраста на 60-80% состоят из воды. При этом в клетках головного мозга воды около 85% и даже в зубной эмали её содержится примерно 12%. Если же в результате обезвоживания организм потеряет всего пятую часть этой воды, то неизбежно последует летальный исход. Поэтому восполнять потери воды необходимо ежедневно и только чистой жидкостью, т.к. грязная вода опасна для здоровья человека.
Откуда железо и марганец в воде
Считается что самыми частыми загрязнителями питьевой воды являются железо и марганец. Перед тем, как попасть в источник, дождевая вода проходит через почву и различные породы, растворяя по пути минеральные отложения и обогащаясь положительными ионами упомянутых металлов. Также способствуют превышению в воде марганца и железа не только стоки промышленных предприятий и жилых кварталов, но и сельскохозяйственная деятельность человека. Излишки внесенных на поля удобрений также попадают в воду.
Нормы железа и марганца в воде
Часто вода из природных источников по содержанию железа многократно превышает ПДК, который не должен превысить 0,3 мг/л. Железа в артезианской или в колодезной воде может быть и 4, и 10, и даже 30 миллиграмм на литр. При этом железистая вода зачастую содержит и повышенную концентрацию марганца. СанПиН ограничивает содержание марганца на максимальном уровне 0,1 мг/л. В отдельных европейских странах этот порог еще ниже — 0,05 мг/л. Присутствие железа и марганца в воде отрицательно влияет на нашу жизнь.
Можно ли пить воду с высоким содержанием железа и марганца, её влияние на организм человека
Разберем влияние воды с повышенным содержанием железа и марганца на человеческий организм. Медики диагностируют пагубное влияние высокой концентрации железа на органы кроветворения и состояние человеческого сердца. Повышенный марганец в воде тоже негативно отражается на здоровье — в первую очередь на нервной и сердечно-сосудистой системе. Мутагенное и токсическое влияние внешне отражается в виде серовато-черного цвета ногтей и зубов.
Как определить содержание в воде железа и марганца
Главные признаки растворенного железа и марганца в воде: это металлический привкус и характерных запах. Мутность и появляющийся осадок тоже свидетельствуют о высокой концентрации железа. Марганец также придает воде неприятный вяжущий привкус, а на сантехнике появляются черные пятна. Но надежнее всего будет проведение химического анализа в профессиональной лаборатории. Полученный там протокол будет содержать ионы железа и марганца в воде, по которым воду нужно очищать.
Как очистить воду от железа и марганца
Чем очистить воду от железа и марганца в каждом случае устанавливается индивидуально, так как различная концентрация и другие факторы не позволяют выбрать один универсальный метод. Прежде всего, нужно учитывать, что металлы могут находиться в воде в виде раствора и в форме взвесей (окислов). Жидкость из артезианских источников, чаще всего, содержит металлы в растворенном виде, т.к. там отсутствует свободный кислород. Вода из открытых источников (реки) включает примеси в виде взвесей.
Рассмотрим самые эффективные способы удаления марганца и железа из воды.
Фильтры для воды от железа и марганца + аэрация
На первом месте заслуженно находится метод очистки воды из скважины от железа марганца, в котором используются фильтры обезжелезивания. Они отлично удаляют из воды не только растворенное железо, но двухвалентный марганец. Существует два вида таких фильтров, которые отлично удаляют из воды железо и марганец: реагентные (устаревший тип) и безреагентные. В первом фильтрующая среда представляет собой окислитель растворенного металла, который после использования восстанавливается перманганатом калия.
Во втором случае окисление примесей осуществляется в напорной аэрационной колонне. Аэрация помогает для эффективной очистки воды от железа, марганца, сероводорода. Для этого используются засыпные фильтры, внутри которых помещается зернистый материал. На поверхности частиц подаваемый с напором кислород воздуха преобразует растворенные металлы в хлопья. В дальнейшем, при обратной промывке фильтра, эти нерастворимые в воде хлопья смываются в канализацию. Никакого химического восстановления фильтрующей среды не требуется.
Оба типа фильтров для очистки воды от марганца и железа необходимо периодически обслуживать и регенерировать. Фильтры первого типа (реагентные) промываются раствором перманганата калия, а второго типа (безреагентные) — обратной промывкой простой водой. Обслуживание фильтров для воды от железа и марганца можно производить вручную или автоматически. Ручной способ заключается в переключении кранов, а автоматический — в том же, но при помощи управляющего клапана (электромеханического или электронного). Естественно, что автоматизированные фильтры стоят дороже.
Ионообменные фильтры для очистки воды от марганца и железа
Этот метод удаления железа и марганца из воды основан на ином принципе очистки. Тут нет окисления растворенных металлов. Ионообменные смолы вбирают в себя двухвалентное железо, замещая его катионами натрия. Это не только освобождает воду от примесей тяжелых металлов, но и умягчает её. Существуют и модели ионообменных фильтров, которые можно регенерировать. При этом методе удаления из воды железа, марганца рекомендуется предварительно очищать воду от трехвалентного (нерастворимого) железа при помощи механических фильтров.
Обратный осмос — метод снижения железа и марганца в воде
Это один из самых дорогостоящих и сложных в обслуживании методов. Очистка воды от железа, марганца и других примесей проходит при помощи специальной мембраны. Она пропускает молекулы воды и все, что меньше по размеру. Остальное отфильтровывается и удаляется в канализацию. Полученная вода почти дистиллят и поэтому подлежит искусственной минерализации.
Химическая очистка с помощью реагентов
Система очистки воды от железа и марганца, где в качестве реагента используется гипохлорит, требует к себе особого отношения. Это вещество, которое выделяет кислород. Иногда используется и диоксид марганца. В бак помещается реагент, через который пропускают очищаемую воду. Железо окисляется и выпадает в осадок. Далее вода идет на финишную очистку через угольный фильтр. Однако, превышение дозы реагентов может сделать небезопасной питьевую воду.
Как очистить воду от железа и марганца с помощью дистилляции и отстаивания
Дистилляция осуществляется при большом потреблении тепла/электроэнергии. Испаренная вода лишается всех неорганических примесей. Конденсат является высокоочищенной водой малопригодной для бытовых нужд. Отстаивание осуществляют в больших емкостях. Большая поверхность соприкосновения с воздухом быстро окисляет растворенные металлы, которые в дальнейшем отсекаются механическим фильтром. Изредка дополнительно засыпают кальцит, который корректирует водородный показатель.
Мы знаем, как удалить железо и марганец из воды
Учитывая негативное влияние, которое оказывают на человеческий организм повышенные концентрации в воде железа и марганца, не рекомендуется рисковать и употреблять неочищенную воду. Необходимо получить экспертное заключения аккредитованной лаборатории и принять меры к очищению воды от найденных превышений ПДК. Доверить эту работу лучше всего профессионалам, занимающимся системами очистки воды уже не первый год. Они подберут нужные для конкретной ситуации фильтры для железа и марганца в воде, которые на выходе будут давать питьевую воду превосходную по всем параметрам.
Наша компания предложит любому клиенту именно то, что ему необходимо. От оборудования для водоподготовки промышленных масштабов до системы водоочистки для индивидуального коттеджа, от системы обратного осмоса, произведенной на собственных производственных мощностях, до систем опреснения и дистилляции для медицинских целей. Звоните, и мы поможем вам подобрать лучшую систему для очистки воды от железа и марганца.
Очистка воды от марганца: особенности и методы
Текущие санитарные нормы ограничивают предельно допустимое содержание марганца в хозяйственной и питьевой воде – допустимая норма составляет 0,1 мг/л. В некоторых европейских странах требования еще жестче – до 0,05 мг/л. Если содержание элемента выше, страдают органолептические свойства воды, появляется неприятный привкус, на сантехнике образуются характерные пятна, а на трубах собирается осадок (он имеет вид черной пленки). В подземных водах элемент содержится в виде растворимых солей Mn2+. Чтобы очистить воду от марганца, его сначала нужно перевести окислением в нерастворимое состояние, после чего начнутся процессы гидролизации с образованием нерастворимых гидроксидов Mn(OH)3, Mn(OH)4. При осаждении на загрузке фильтра начинает проявлять каталитические свойства, ускоряя окисление двухвалентного марганца кислородом. Для эффективного окисления элемента кислородом нужно, чтобы значение рН воды, которая проходит очистку, находилось в районе 9.5-10.0. Перманганат калия, гипохлорит натрия или хлор, озон позволяют вести процессы демаганации при меньших показателях рН – например, 8.0-8.5. Для окисления 1 мг марганца, растворенного в воде, требуется около 0.291 мг кислорода.
Очистка воды от железа и марганца: обезжелезивание и деманганация (удаление марганца). Нужно ли очищать воду из скважины
Железо и марганец – самые распространенные загрязнители водных источников. Вода просачивается через грунтовые минеральные отложения и насыщается катионами данных металлов. Если норма железа превышается, то и содержание марганца часто оказывается критическим. Для исправления ситуации проводится деманганация (процесс удаления марганца из воды).
Марганец, как и железо, может пребывать в двух состояниях – растворенном и окисленном. В подземных источниках кислорода нет, поэтому марганец содержится в них в растворенном виде. Для удаления его из воды в данном случае применяются те же методики, что при обезжелезивании. То есть сначала нужно будет окислить марганец, а затем уже убрать взвеси из воды.
Важность очистки воды от марганца
Избыток марганца придает воде характерный желтый оттенок и вяжущий привкус. От такой воды на трубах и сантехнике появляются темные пятна и черные наросты. Но главное даже не это, а то, что постоянное употребление в пищу тяжелых металлов чревато очень неприятными последствиями (они склонны накапливаться). Негативно влияет избыток марганца на работу ЦНС, состояние сердечно-сосудистой системы и скелета. Во время беременности данный элемент особенно опасен, поскольку он сказывается на развитии ребенка.
Современные способы (методы) и процесс глубокой очистки воды из скважины от марганца. Оборудование и материалы для фильтрации
Важнейшее условие качественной очистки водных масс от марганца – требуемый уровень водородного значения рН, поскольку из-за химического состава окисление данного элемента (в отличие от обычного железа) происходит сложнее. При показателе от pH 7.5 ионы марганца принимают нерастворенную форму, а если он ниже 7.0, эффективное удаление элемента становится просто невозможным. В данном случае в целях повышения водородного показателя могут использоваться фильтры корректоры pH с кальцитом – зернистыми мраморными фракциями.
Для дальнейшей очистки потребуется окислитель, поскольку содержащегося в воде элемента обычно оказывается недостаточно. Решить проблему помогают эжекторы-аэраторы.
Очистка воды от марганца с применением обезжелезивателя
В грунтовых водах, в которых кислорода нет вообще, марганец присутствует в двухвалентной растворенной форме. Чтобы удалить его из воды, сначала нужно будет произвести окислительные реакции, а потом фильтрацию. Хорошие результаты показывают фильтры-обезжелезиватели.
Очистка воды от марганца с применением фильтра комплексной очистки
Фильтры комплексной очистки стоят дороже остальных решений, зато эффективно удаляют марганец при любых заданных значениях pH. Насыщать воду кислородом при этом не требуется. Многокомпонентная фильтрующая среда комплексных установок также гарантирует эффективную очистки воды от железа, солей жесткости, органики и прочих примесей, которые в ней растворены. Данный вид водоочистки очень эффективен в удалении марганца из колодезной и скважинной воды. Один такой фильтр заменяет сразу несколько устройств разного назначения.
Очистка воды от марганца с применением накопительных баков
Также удаление марганца из колодезной воды может производиться с применением накопительных баков. Сначала в целях лучшего окисления выполняется корректировка водородного показателя кальцитом (его засыпают на дно колодца либо в накопительный газ). Окислительные процессы запускает аэрационное устройство – эжектор. После прохождения эжектора насыщенная воздухом вода поступает в накопительную емкость, где продолжаются окислительные реакции. Затем вода начинает подаваться насосной станцией на фильтр промывной титановой мембраны. Частики марганца от 0.1 микрон, которые не смогли раствориться, удерживаются поверхность мембраны.
Принципы работы фильтрационной системы и удаление марганца из воды
На первой стадии очистки из воды вакуумом убирают свободную углекислоту, в результате чего рН повышается до 8.0-8.5. Упрощает выполнение работ вакуумно-эжекционный аппарат, в эжекционной части которого происходит диспергирование воды с последующим насыщением кислородом воздуха. Затем вода подается на фильтрацию через зернистую загрузку (это может быть кварцевый песок или другой материал). Данный метод очистки применим при перманганатной окисляемости до 9.5 мгО/л. В воде обязательно присутствует двухвалентное железо, при окислении которого получается гидроксид железа, адсорбирующий и каталитически окисляющий Mn2+. Соотношение концентраций [Fe2+] / [Mn2+] меньше 7/1 быть не должно. Если в исходной водной среде такое соотношение достичь не получается, в нее добавляют сульфат железа.
Очистка воды от марганца перманганатом калия
Методика применима для поверхностных и подземных вод. При введении перманганата калия в воду растворенный марганец окисляется, в результате образуется малорастворимый оксид марганца. Осажденный оксид в виде хлопьев имеет значительную развитую удельную поверхность – около 300 м2 на 1 г осадка. Осадок – отличный катализатор, который позволяет проводить демангацию при рН около 8.5. Для удаления Mn2+ в количестве 1 мг нужно 1.92 мг перманганата калия. Как мы уже писали выше, перманганат калия убирает из воды и марганец, и железо в любых формах. Также удаляются неприятные запахи, за счет сорбционных свойств повышают вкусовые качества воды. Практические данные относительно очистки воды от марганца с применением перманганата калия показывают – нужно использовать 2 мг вещества на каждый 1 мг марганца, процент окисления будет составлять до 97%. Mn2+. После перманганата для удаления продуктов окисления, взвешенных веществ вводят коагулянт. Затем вода фильтруется на установке песчаной загрузки. При очистке подземных вод от марганца параллельно с перманганатом вводят активированную кремниевую кислоту либо флокулянты. Это позволяет увеличить хлопья оксида марганца в размерах.
Очистка воды от марганца каталитическим способом
При очистке воды от марганца и железа предварительное осаждение оксидов на поверхность зерен фильтра оказывает каталитическое воздействие на процесс окисления двухвалентного марганца кислородом (кислород используется растворенный). В процессе фильтрации предварительно аэрированной и, если это нужно, то подщелоченной воды на зернах фильтра песчаной загрузки образуется осадок гидроксида марганца Mn(OH)4. Ионы Mn2+ адсорбируются гидроксидом марганца и гидролизуются с получением Mn2O3. Последний элемент окисляется до Mn(OH)4 растворенным кислородом и снова принимает участие в каталитическом окислении. Как любой классический катализатор, элемент Mn(OH)4 практически не расходуется.
Очистка воды от марганца на модифицированной загрузке
Для увеличения рабочего ресурса фильтрующей загрузки за счет крепления пленки катализатора из оксида марганца и гидроксидов железа на поверхности зерен, для уменьшения расхода перманганата калия чаще всего используется именно модифицированная загрузка. До начала процесса фильтрования через фильтрующую загрузку пропускают сначала раствор железного купороса (FeSO4) с перманганатом калия, потом загрузку обрабатывают тринатрийфосфатом (формула Na3PO4) либо сульфитом натрия (Na2SO3). Ориентировочная скорость фильтрации воды будет составлять 8-10 м/час. Каталитическую пленку можно сделать точно так же, пропуская 0.5%-ный раствор хлорида марганца с перманганата калия через загрузку фильтра.
Очистка воды от марганца введением реагентом
Скорость окисления двухвалентного марганца хлором, диоксидом хлора, озоном либо гипохлоритом натрия зависит от показателя рН исходной воды. При введении гипохлорита натрия либо хлора эффект окисления достигается в полной мере при рН от 8.0-8.5 и времени контакта воды с окислителем один-полтора часа. В большинстве случаев обрабатываемая вода подщелачивается. Требуемая доза реагента для перевода Mn2+ в Mn4+ составляет 1.3 мг на каждый миллиграмм двухвалентного растворенного марганца. Фактические дозы будут выше.
Очистка воды от марганца диоксидом хлора или озоном
Данный тип обработки является одни из наиболее эффективных. Процесс окисления марганца занимает всего 10-15 минут при значении рН 6.5-7.0. Доза озона согласно стехиометрии составляет 1.45 мг, диоксида хлора – 1.35 мг на милиграмм двухвалентного марганца. Но поскольку озон подвергается каталитическому разложению оксидами марганца, доза должна быть увеличена. Все указанные количества KMnO4, ClO2, O3 верны, но они чисто теоретические. Практические дозы окислителей зависят от рН, срока контакта окислителя и воды отложений, содержания органических примесей и других показателей.
Очистка воды от марганца ионным обменом
Очистка воды от марганца способом ионного обмена, как и железа, происходит при водород и натрий катионировании. Методика целесообразна при необходимости глубокого умягчения, обезжелезивания и удаления марганца.
В каких случаях нужна очистка воды от железа и марганца
О высоком содержании марганца в воде свидетельствуют потеки коричнево-желтого цвета на сантехнике, желтизна на одежде, металлический привкус. Но это критерии, которые определяются на глаз, а есть еще и санитарные нормы. Они определяют предельно допустимые параметры содержания марганца в воде, даже если потеков, пятен и металлического вкуса нет, фильтрация является обязательной.
Откуда берутся железо и марганец в воде?
Железо и марганец в воду попадают из горных пород, стоков промышленных предприятий, удобрений. В природе элементы существуют в двух- и трехвалентной формах.
Фильтры для очистки воды от железа и марганца: основные материалы
Рассмотрим самые распространенные фильтрующие материалы, используемые для удаления марганца:
- Упаковки с фильтрами Birm. Устройства устанавливаются под аэраторами.
- Bewaclean – аналогичное предыдущему решение. Дополнительно данный фильтр регулирует кислотность очищаемой воды.
- Green sand – помимо марганца и железа, фильтр удаляет еще и сероводород. Для регенерации используется перманганат калия.
- МТМ – более компактный аналог Greensand с pH 6.2- 8.5.
- Pyrolox – минеральная форма марганца диоксида. Химической регенерации не требует.
Любой фильтрующий материал время от времени нужно очищать, пропуская по нему воду в обратном обычному направлению с высокой скоростью. Воду после промывки использовать в пищевых и питьевых целях нельзя.
Современные системы очистки воды для коттеджа, квартиры, дома и дачи. Варианты обустройства очистительной системы
В квартире, доме или на даче для удаления марганца удобнее всего использовать следующие системы:
- Фильтры с ионообменным картриджем.
- Фильтры обратного осмоса.
- Устройства каталитического окисления.
- Отстаиватели.
Каждый вариант имеет свои особенности, недостатки и стоимость. Перед принятием окончательного решения о выборе рекомендуем проконсультироваться со специалистами.
почему необходимо очищать воду от марганца
Марганец принято относить к группе тяжелых металлов, это вещество распространено не столь сильно, как железо, но встречается довольно часто, и по своим свойствам напоминает само железо. В результате повышенного содержания марганца в воде на внутренних поверхностях водопроводных труб и водогрейного оборудования начинают накапливаться отложения этого металла, которые, в свою очередь, могут вызывать закупорку и ухудшение процессов теплообмена, поэтому следует задуматься о качественной водоочистке. Кроме того, такая вода оставляет несмываемые следы на сантехнических устройствах. Стоит также отметить, что это далеко не весь вред, который может принести жидкость с повышенной концентрацией марганца, так марганец в питьевой воде является одной из основных причин ее неприятного вкуса, к тому же употребление такой жидкости для утоления жажды и приготовления пищи негативно сказывается на состоянии человеческого организма. Как показали последние исследования, употребление воды, чрезмерно обогащенной марганцем, приводит к снижению интеллектуальных способностей у детей. Постоянное употребление питьевой воды, в которой концентрация марганца превышает 0,1 мг/л, может спровоцировать возникновение серьезных заболеваний костной системы.
Решения BWT для обезжелезивания воды:
Стоит отметить, что на сегодняшний день проблема повышенного содержания марганца в питьевой и водопроводной воде стоит практически также остро, как и проблема воды с повышенной концентрацией железа. По этой причине во многих современных государствах, в том числе и в Российской Федерации, удаление марганца и железа – это одна из основных задач водоочистки. Не смотря на это, многие люди устанавливают в своих домах и квартирах дополнительные фильтрующие системы с целью получения оптимального состава жидкости, столь необходимой всем живым организмам для нормального существования.
Если в водопроводной или в питьевой воде превышена допустимая концентрация марганца, то жидкость приобретает желтоватый оттенок и имеет малоприятный вяжущий привкус. Пить такую воду не только неприятно из-за плохого вкуса, но и опасно для здоровья. Так, повышенное содержание марганца в питьевой воде грозит заболеваниями печени, в которой, в основном, и концентрируется этот металл. Кроме того, марганец, употребленный вместе с водой, имеет способность проникать в тонкий кишечник, кости, почки, железы внутренней секреции и даже поражать головной мозг. Важно знать, что в результате постоянного употребления питьевой воды, в которой превышено содержание данного химического элемента, может начаться хроническое отравление этим опасным для здоровья металлом. Отравление имеет либо неврологическую, либо легочную форму. В случае неврологической формы отравления у пациента могут наблюдаться следующие симптомы:
- Полное безразличие к происходящим вокруг событиям;
- Сонливость;
- Потеря аппетита;
- Головокружения;
- Сильные головные боли.
Если же отравление было крайне сильным, не исключена потеря координации движений, судороги, боли в спине, резкая перемена настроения. Люди, отравившиеся марганцем, могут внезапно расплакаться или же наоборот расхохотаться. Ко всему вышеперечисленному добавляется повышенный тонус лицевых мышц, который является причиной изменения выражения лица больного. Так что марганец в питьевой воде крайне опасен для здоровья человеческого организма.
Все вышеперечисленное позволяет без тени сомнения заявлять о необходимости очистки питьевой и обычной водопроводной воды в случае, если концентрация марганца превышает допустимые нормы, а точнее 0,1мг/л. Более того в некоторых странах предельная концентрация марганца не превышает 0,05 мг/л – настолько опасным считается это вещество. В целом все существующие на сегодняшний день способы водоподготовки и очищения воды от марганца сводятся к следующему принципу. Первоначально происходит окисление двухвалентного марганца (именно в этой форме он поступает в водопроводные коммуникационные системы из природных источников) до трех- и четырехвалентного марганца. Окисленный четырехвалентный марганец в результате реакции с определенным веществом образует нерастворимый осадок, который устраняется посредством фильтров механической очистки. В роли нерастворимого осадка могут выступать оксиды, гидроксиды или же соли кислот; вид осадка, в первую очередь, зависит от типа используемого реагента и выбранного метода.
Смотрите также:
Марганец в воде — как влияет на здоровье человека?
Независимый испытательный центр vodalab рассказывает о марганце, его влиянии на здоровье человека и способах очистки воды от марганца.
Общая информация:
Марганец является одним из наиболее распространенных загрязнителей в источниках нецентрализованного водоснабжения. Практически всегда загрязнение по марганцу встречается вместе с высоким содержанием железа в воде. В воду марганец попадает вместе с талыми водами и грунтовыми потоками, продуктами выветривания минералов и выщелачивания железомарганцевых руд, а также в процессе разложения растительных организмов. Марганец (II) образует растворимые комплексы с бикарбонатами и сульфатами. Высокое содержание марганца способствует переходу железа в трехвалентную нерастворимую форму из растворимой двухвалентной. В отличие от железа, которое оставляет рыжий осадок в воде, марганец обычно дает темно-коричневый либо черный осадок. Отложения марганца накапливаются на бытовой технике, что часто приводит к ее выводу из строя либо быстрой поломке.


Нормы СанПиН по марганцу:
Согласно СанПиН 2.1.4.1074-01 предельно допустимая концентрация марганца составляет 0,1 мг/л. Стоит отметить, что во многих странах ЕС нормы по марганцу еще более строгие: 0,05 мг/л. Мы рекомендуем употреблять воду с минимально возможны содержанием марганца.
Влияние на здоровье человека:
Содержание марганца выше 0,1 мг/л считается нежелательным и может привести к отравлению. Высокое содержание марганца приводит к подавлению нормальной работы нервной системы. Считается, что одной из причин, способствующих развитию болезни Паркинсона является марганцевое отравление.
Аллергические реакции, быстрая утомляемость, ухудшение памяти, ломкость костей также могут свидетельствовать о том, что содержание марганца в воде не соответствует установленным нормам.
В очень редких случаях при получении высоких доз марганца у человека могут наблюдаться паркинсонизмы.
Способы избавления от марганца в воде
Избавиться от высоких концентрация марганца в воде сложнее, чем от железа. Процесс удаления марганца называется деманганацией.
Для деманганации воды используется окисление марганца до трех- и четырехвалентной формы. Окисленные формы образуют гидроксиды Mn(OH)3 и Mn(OH)4, которые являются нерастворимыми. Далее на фильтрующей загрузке (Manganesse Greensand, МЖФ, Pyrolox либо Birm) происходит осаждение нерастворимых форм.
Как и при удалении железа из воды, марганец можно убрать безреагентным и реагентным способами.Важной особенностью безреагентного удаления марганца является то, что pH очищаемой воды должен быть на уровне > 8 — 8,5. В таком случае можно говорить о том, что аэрационная колонна позволит эффективно окислять марганец.
Исследование на марганец проводится в каждом из анализов, начиная с «базового», среди представленных на нашем сайте vodalab
Очистка воды от железа и марганца: процесс, оборудование, технологические схемы
Фильтрующие колонны чаще всего выполняются из пластика, усиленного стекловолокном |
Вода из подземных водозаборов часто содержит недопустимую концентрацию железа и марганца. В таких случаях ее необходимо подвергать очистке. В данной статье рассматривается процесс очистки воды от железа и марганца: его принципы, технологические схемы, материалы и оборудование для очистки.
В КАКИХ СЛУЧАЯХ НУЖНА ОЧИСТКА ВОДЫ ОТ ЖЕЛЕЗА И МАРГАНЦА
Об избытке железа в воде могут свидетельствовать желто-коричневые потеки на сантехнике, желтоватые пятна на вещах, выстирываемых в стиральной машине, металлический привкус воды. Но это критерии, определяемые, так сказать, на глаз. Существуют и Государственные санитарные нормы. Например, в Украине это «Гигиенические требования к воде питьевой, предназначенной для потребления человеком» (ГСанПиН 2.2.4-171-10). Согласно им, концентрация железа в водопроводной воде не должна превышать 0,2 мг/куб.дм, а марганца – 0,05 мг/куб.дм. Требования к воде, получаемой из колодцев и глубинных водозаборов менее жесткие: 1,0 мг/куб.дм и 0,5 мг/куб.дм соответсвенно.
ОТКУДА БЕРУТСЯ ЖЕЛЕЗО И МАРГАНЕЦ В ВОДЕ
Железо и марганец могут попадать в воду как естественным путем – из горных пород, так и техногенным: железо – из отходов металлургических предприятий, марганец – из стоков горнодобывающих предприятий, а также из удобрений, применяемых в сельском хозяйстве.
Железо в воде встречается в двух формах: двухвалентной – Fe(II) и трехвалентной — Fe(III). В поверхностных водах преобладают нерастворимые в воде соединения железа Fe(III). Они вступают в контакт с кислородом, содержащемся в воздухе, и выпадают в виде осадка. Поэтому концентрация железа в поверхностных водах невелика. В глубинных водах, без контакта с кислородом, железо содержится преимущественно в форме Fe(II). Его концентрация в воде может быть весьма различной – от нормы до 10 и более мг/куб.дм.
Марганец содержится в глубинных водных горизонтах в двухвалентной форме Mn(II). Очень часто он присутствует в воде вместе с железом, но его концентрация меньше, чем железа – не более 10 мг/куб.дм.
ПРОЦЕСС ОЧИСТКИ ВОДЫ ОТ ЖЕЛЕЗА И МАРГАНЦА
Принцип очистки воды от железа заключается в окислении растворимой в воде двухвалентной формы железа Fe(II) до нерастворимой трехвалентной Fe(III), а она, в свою очередь, уже удаляется из воды при помощи фильтрации.
Очистка воды от марганца производится по тому же принципу. Разница заключается лишь в том, что растворимая двухвалентная форма марганца Mn(II) окисляется до нерастворимой четырехвалентной Mn(IV).
ОБОРУДОВАНИЕ ДЛЯ ОЧИСТКИ ВОДЫ
Основными элементами системы очистки воды от железа и марганца являются аэратор, предназначенный для насыщения воды кислородом и фильтрующая колонна.
Аэратор монтируется перед фильтрующей колонной. Между ним и фильтрующей колонной желательно смонтировать контактную емкость, чтобы вода лучше насытилась кислородом. В некоторых случаях можно обойтись без аэратора, а закачивать воздух компрессором сразу в фильтр.
Некоторые виды фильтрующих материалов являются сильными окислителями. Если применяются такие материалы, то аэратор, как правило, также не требуется. Железо окисляется и оседает на поверхности частиц фильтрующего материала.
Фильтрующие материалы подбирают в зависимости от состава воды. Прежде всего, необходимо определиться с качеством воды, которое необходимо получить. Далее учитываются такие параметры, как концентрация соединений железа и марганца в воде, их форма, кислотность воды (Ph), содержание в воде кислорода или углекислого газа, а также присутствие сероводорода или аммиака. Также играют роль параметры водопровода (напор и производительность). Данные о составе воды можно получить в лаборатории санэпидемстанции. С заключением санэпидемстанции уже можно обращаться в специализированную фирму для подбора состава очистительного оборудования.
ФИЛЬТРУЮЩИЕ МАТЕРИАЛЫ
Вот некоторые из распространенных фильтрующих материалов:
Birm применяется для очистки воды от железа и марганца при показателях кислотности pH 6,8 – 9 для железа, 8 – 9 для марганца. Фильтр устанавливается перед аэратором.Упаковки с фильтрующими материалами
- Bewaclean является подобным материалом, кроме того, он корректирует кислотность воды.
- Green sand применяют для очистки воды, содержащей, кроме значительного количества железа и марганца, еще и сероводород. Этот фильтрующий материал эффективен при низкой реакции рН – от 6,2 до 8,5. Его регенерируют перманганатом калия.
- МТМ хорошо работает в таких же условиях, как Greensand (pH 6,2 – 8,5). Но он отличается небольшим весом (приблизительно втрое легче, чем Greensand). Поэтому его используют там, где могут возникать проблемы с обеспечением необходимого давления для промывки. Он тоже регенерируется с помощью перманганата калия KMnO4.
- Pyrolox – минеральная форма диоксида марганца. Отличается большгим весом. Применяется при показателях pH 6,5 – 9. Очищает воду от железа, марганца и сероводорода. Этот материал не требует химической регенерации, но ему необходимо обеспечить качественную очистку.
Периодически любой фильтрующий материал необходимо очищать. Для этого вода через него пропускается в направлении, противоположном обычному, со скоростью, в 1,5 – 2 раза больше нормальной. Это необходимо для того, чтобы «взболтать» фильтрующий материал и удалить из него накопившиеся загрязняющие частицы. Вода после промывки фильтра непригодна для какого-либо использования и должна отводиться в канализацию.
НЕКОТОРЫЕ ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ СИСТЕМ ДЛЯ ОЧИСТКИ ВОДЫ ОТ ЖЕЛЕЗА И МАРГАНЦА
Если в воде присутствует только железо в количестве нескольких мг/дм3, в основном в виде бикарбонатных солей, содержание марганца и цвет в норме, а реакция рН превышает 7, можно использовать самый простой способ удаления соединений железа — аэрацию и фильтрацию через песчаный фильтрующий слой. Если, кроме железа, присутствует и марганец, используется каталитический фильтрующий материал. |
В системе водоснабжения, где давление воды в трубопроводах обеспечивается с помощью насосной станции, можно использовать фильтр, работающий в комплекте с компрессором. В этом случае устранение соединений железа обеспечивают гравийно-песчаные фильтрующие материалы. Байпас (обход) встроен в управляющую головку (управляющий клапан). |
Когда вода содержит железо и марганец в большей концентрации, а в ней присутствует сероводород (или аммиак) или показатель кислотности воды рН ниже 7,5, необходимо использовать каталитические фильтрующие материалы, регенерируемые КМпО4. В этих случаях к фильтрующей колонне при помощи гибкого шланга подсоединяют емкость с раствором для регенерации фильтрующего материала. |
(Подготовлено для сайта «Моя усадьба» http://mymanor.ru)
Марганец — Википедия
| Марганец | |
|---|---|
| ← Хром | Железо → | |
| Твёрдый, хрупкий металл серебристо-белого цвета | |
 Электролитический марганец | |
| Название, символ, номер | Марганец / Manganum (Mn), 25 |
| Атомная масса (молярная масса) | 54,938045 (5)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s2 |
| Радиус атома | 127 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+7e) 46 (+2e) 80 пм |
| Электроотрицательность | 1,55 (шкала Полинга) |
| Электродный потенциал | −1,180 В |
| Степени окисления | 7, 6, 5, 4, 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 716,8 (7,43) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,21 г/см³ |
| Температура плавления | 1 517 K |
| Температура кипения | 2 235 K |
| Уд. теплота плавления | 13,4 кДж/моль |
| Уд. теплота испарения | 221 кДж/моль |
| Молярная теплоёмкость | 26,3[2] Дж/(K·моль) |
| Молярный объём | 7,35 см³/моль |
| Структура решётки | кубическая |
| Параметры решётки | 8,890 Å |
| Температура Дебая | 400 K |
| Теплопроводность | (300 K) 6,87[3] Вт/(м·К) |
| Номер CAS | 7439-96-5 |
| 25 | Марганец |
| 3d54s2 | |
Ма́рганец — элемент 7-й группы (по устаревшей классификации — побочной подгруппы седьмой группы) четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой[2].
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 году шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от нем. Manganerz — марганцевая руда).
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Массовая доля марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железомарганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца[править | править код]
- Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
- 4MnO2⟶2Mn2O3+O2{\displaystyle {\ce {4 MnO2 -> 2 Mn2O3 + O2}}}
- Mn2O3+2Al⟶2Mn+Al2O3{\displaystyle {\ce {Mn2O3 + 2 Al -> 2 Mn + Al2O3}}}
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (~80 % Mn).
- Чистый металлический марганец получают электролизом.
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент теплового расширения: 0,000022 K−1 (при 0 °C)
- Электропроводность: 0,00695⋅106 Ом−1·см−1
- Теплопроводность: 0,0782 Вт/(см·K)
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость:
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4[4]
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см³/моль
| Окисленная форма | Восстановленная форма | Среда | E0, В |
|---|---|---|---|
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
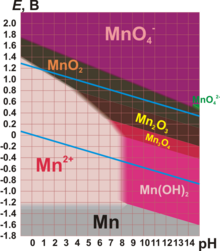
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
- Mn+O2⟶MnO2{\displaystyle {\ce {Mn + O2 -> MnO2}}}
Марганец при нагревании разлагает воду, вытесняя водород:
- Mn+2h3O→∘tMn(OH)2+h3↑{\displaystyle {\ce {Mn{}+2h3O->[^{\circ }t]Mn(OH)2{}+h3\uparrow }}}
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
- Mn+2H+⟶Mn2++h3↑{\displaystyle {\ce {Mn{}+2H^{+}->Mn^{2}+{}+h3\uparrow }}}
С концентрированной серной кислотой реакция идёт по уравнению
- Mn+2h3SO4⟶MnSO4+SO2↑+2h3O{\displaystyle {\ce {Mn{}+2h3SO4->MnSO4{}+SO2\uparrow +2h3O}}}
С разбавленной азотной кислотой реакция идёт по уравнению
- 3Mn+8HNO3⟶3Mn(NO3)2+2NO↑+4h3O{\displaystyle {\ce {3Mn{}+8HNO3->3Mn(NO3)2{}+2NO\uparrow +4h3O}}}
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
- 2MnO2+4KOH+O2⟶2K2MnO4+2h3O{\displaystyle {\ce {2 MnO2{}+ 4 KOH{}+ O2 -> 2 K2MnO4{}+ 2 h3O}}}
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
- 3K2MnO4+3h3SO4⟶3K2SO4+2HMnO4+MnO(OH)2↓+h3O{\displaystyle {\ce {3 K2MnO4{}+ 3 h3SO4 -> 3 K2SO4{}+ 2 HMnO4{}+ MnO(OH)2 v + h3O}}}
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
- 2KMnO4→∘tK2MnO4+MnO2+O2{\displaystyle {\ce {2KMnO4->[^{\circ }t]K2MnO4{}+MnO2{}+O2}}}
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
- 2MnSO4+5PbO2+6HNO3⟶2HMnO4+2PbSO4+3Pb(NO3)2+2h3O{\displaystyle {\ce {2 MnSO4{}+ 5 PbO2{}+ 6 HNO3 -> 2 HMnO4{}+ 2 PbSO4{}+ 3 Pb(NO3)2{}+ 2 h3O}}}
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». В нейтральных или кислых водных растворах ион Mn2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6]2+.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
- MnO2+4HCl⟶MnCl2+Cl2↑+2h3O{\displaystyle {\ce {MnO2{}+4HCl->MnCl2{}+Cl2\uparrow +2h3O}}}
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53Mn (период полураспада T1/2 = 3,7 млн лет), 54Mn (T1/2 = 312,3 суток) и 52Mn (T1/2 = 5,591 суток). Преобладающим каналом распада лёгких изотопов марганца (А < 55) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов (А > 55) основным каналом распада является β−-распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс.
Применение в металлургии[править | править код]
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой вместе с В. И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах.[5]
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии[править | править код]
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
Определение методами химического анализа[править | править код]
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+, следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
- MnSO4+2KOH→Mn(OH)2↓+K2SO4{\displaystyle {\mathsf {MnSO_{4}+2KOH\rightarrow Mn(OH)_{2}\downarrow +K_{2}SO_{4}}}}
- Mn2++2OH−→Mn(OH)2↓{\displaystyle {\mathsf {Mn^{2+}+2OH^{-}\rightarrow Mn(OH)_{2}\downarrow }}}
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
- MnSO4+h3O2+2NaOH→MnO(OH)2↓+Na2SO4+h3O{\displaystyle {\mathsf {MnSO_{4}+H_{2}O_{2}+2NaOH\rightarrow MnO(OH)_{2}\downarrow +Na_{2}SO_{4}+H_{2}O}}}
- Mn2++h3O2+2OH−→MnO(OH)2↓+h3O{\displaystyle {\mathsf {Mn^{2+}+H_{2}O_{2}+2OH^{-}\rightarrow MnO(OH)_{2}\downarrow +H_{2}O}}}
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
- 2MnSO4+5PbO2+6HNO3→2HMnO4+2PbSO4↓+3Pb(NO3)2+2h3O{\displaystyle {\mathsf {2MnSO_{4}+5PbO_{2}+6HNO_{3}\rightarrow 2HMnO_{4}+2PbSO_{4}\downarrow +3Pb(NO_{3})_{2}+2H_{2}O}}}
- 2Mn2+
