Какие металлы реагируют с водой?
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
2Na + 2H2O = 2NaOH + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Mg + 2H2O = Mg(OH)2↓ + H2↑
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 оС). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород:
Zn + H2O = ZnO + H2↑
3Fe + 4H2O = Fe3O4 + 4H2 или
Fe + H2O = FeO + H2 (в зависимости от степени нагрева)
Химические свойства металлов
Московский государственный индустриальный университет
Факультет прикладной математики и технической физики
Кафедра химии
Лабораторная работа
Москва 2012
Цель работы. Изучение свойств s-, p-, d-элементов-металлов (Mg, Al, Fe, Zn) и их соединений.
1. Теоретическая часть
Все металлы по своим химическим свойствам являются восстановителями, т.е. они отдают электроны при протекании химической реакции. Атомы металлов относительно легко отдают валентные электроны и переходят в положительно заряженные ионы.
1.1. Взаимодействие металлов с простыми веществами
При взаимодействии металлов с простыми веществами в качестве окислителей обычно выступают неметаллы. Металлы реагируют с неметаллами с образованием бинарных соединений.
1. При взаимодействии с кислородом металлы образуют оксиды:
2Mg
+ O2 2MgO,
2MgO,
2Cu
+ O2 2CuO.
2CuO.
2. Металлы реагируют с галогенами (F2, Cl2, Br2, I2) с образованием солей галогеноводородных кислот:
2Na + Br2 = 2NaBr,
Ba + Cl2 = BaCl2,
2Fe
+ 3Cl2
3. При взаимодействии металлов с серой образуются сульфиды (соли сероводородной кислоты H2S):
Hg + S = HgS,
Zn + S = ZnS.
4. С водородом взаимодействуют активные металлы с образованием гидридов металлов, которые являются солеподобными веществами:
2Na
+ H2 2NaH,
2NaH,
Ca
+ H2 CaH2
CaH2
В гидридах металлов водород имеет степень окисления (-1).
Металлы могут взаимодействовать и с другими неметаллами: азотом, фосфором, кремнием, углеродом с образованием соответственно нитридов, фосфидов, силицидов, карбидов. Например:
3Mg
+ N2 Mg3N2,
Mg3N2,
3Ca
+ 2P  Ca3P2,
Ca3P2,
2Mg
+ Si 
4Al
+ 3C  Al4C3.
Al4C3.
5. Металлы могут также взаимодействовать между собой с образованием интерметаллических соединений:
2Mg + Cu = Mg2Cu,
2Na + Sb = Na2Sb.
Интерметаллическими соединениями (или интерметаллидами) называют соединения, образуемые между собой элементами, которые относятся обычно к металлам.
1.2. Взаимодействие металлов с водой
Взаимодействие металлов с водой – это окислительно-восстановительный процесс, в котором металл является восстановителем, а вода выполняет роль окислителя. Реакция протекает по схеме:
Me + nH2O = Me(OH)n + n/2 H2.
С водой при обычных условиях взаимодействуют щелочные и щелочноземельные металлы с образованием растворимых оснований и водорода:
2Na + 2H2O = 2NaOH + H2,
Ca + 2H2O = Ca(OH)2 + H2 .
Магний реагирует с водой при нагревании:
Mg
+ 2H2O 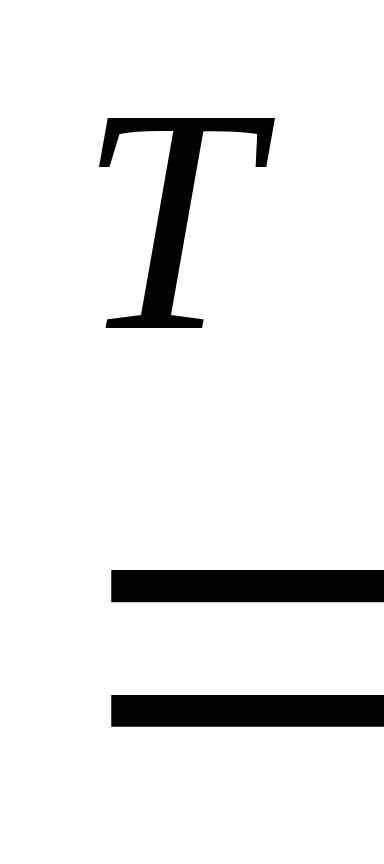 Mg(OH)2
Mg(OH)2
Железо и некоторые другие активные металлы взаимодействуют с горячим водяным паром:
3Fe
+ 4H2O 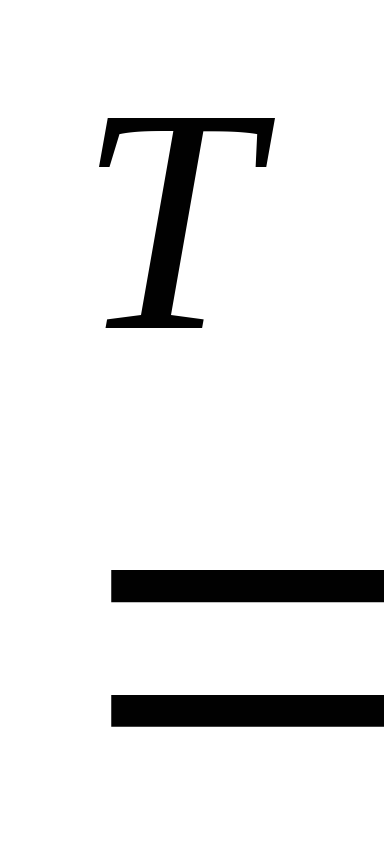 Fe3O4 + 4H2 .
Fe3O4 + 4H2 .
Металлы, имеющие положительные электродные потенциалы, не взаимодействуют с водой.
Не взаимодействуют с водой 4d-элементы (кроме Cd), 5d-элементы и Cu (3d-элемент).
1.3. Взаимодействие металлов с кислотами
По характеру действия на металлы наиболее распространенные кислоты можно разделить на две группы.
1. Кислоты-неокислители:
хлороводородная (соляная, HCl),
бромоводородная (HBr),
йодоводородная (HI),
фтороводородная (HF),
уксусная (CH
2. Кислоты-окислители: азотная (HNO3) в любой концентрации, концентрированная серная (H2SO4(конц.)), концентрированная селеновая (H2SeO4(конц.)) .
Взаимодействие металлов с кислотами-неокислителями. Окисление металлов ионами водорода H+ в растворах кислот-неокислителей происходит более энергично, чем в воде.
Ме + nH + = Men+ + n/2 H2 .
Например:
2Al +6HCl = 2AlCl3 + 3H2 ,
Mg + 2CH3COOH = Mg(CH3COO)2 + H2 ,
2Ti + 6HCl = 2TiCl3 + 3H2 .
Металлы с переменной
степенью окисления (Fe,
Cо,
Ni
и др.) образуют ионы в своей низшей
степени окисления (Fe
Fe + H2SO4(разб) = FeSO4 + H2.
При взаимодействии некоторых металлов с кислотами-неокислителями: HCl, HF, H2SO4(разб.), HCN образуются нерастворимые продукты, предохраняющие металл от дальнейшего окисления. Так, поверхность свинца в HCl (разб) и H2SO4(разб) пассивируется плохо растворимыми солями PbCl2 и PbSO4 соответственно.
Взаимодействие металлов с кислотами-окислителями
Реагируя с металлами как окислитель, H2SO4(конц.) переходит чаще всего в оксид серы (IV) (SO2), а при взаимодействии с сильными восстановителями – в S или H2S:
Me + H2SO4(конц) Me2(SO4)n + H2O + SO2 (S, H2S).
Для удобства запоминания рассмотрим электрохимический ряд напряжений, который выглядит так:
Li, Rb, K, Cs, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au .
В табл. 1. представлены продукты восстановления концентрированной серной кислоты при взаимодействии с металлами различной активности.
Таблица 1.
Продукты взаимодействия металлов с концентрированной
серной кислотой
Тип металла | Продукты восстановления H2SO4(конц.) |
Малоактивные металлы (в ряду напряжений правее Fe) | SO2 |
Металлы, стоящие в ряду напряжений между Al и Cd | Возможно образование трёх продуктов: SO2, S, H2S |
Активные металлы (начало ряда напряжений по Al включительно) | H2S |
Примеры:
Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O,
4Mg + 5H2SO4(конц) = 4MgSO4 + H2S + 4H2O.
Для металлов средней активности (Mn, Cr, Zn, Fe) соотношение продуктов восстановления зависит от концентрации кислоты.
Общая тенденция такова: чем выше концентрация H2SO4 , тем глубже протекает восстановление.
Это означает, что
формально каждый атом серы 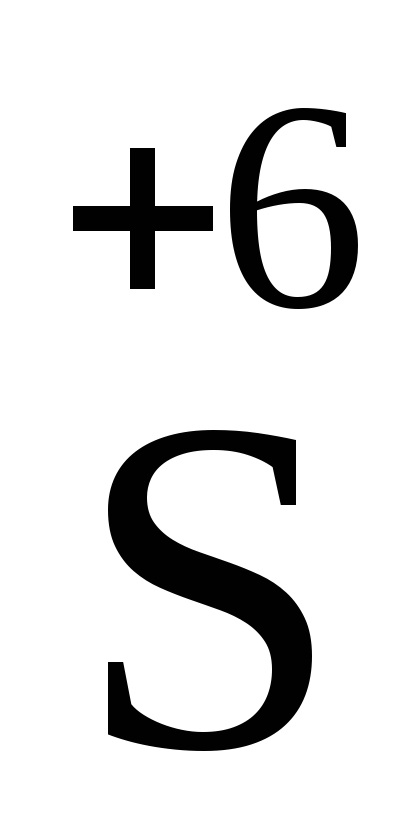 из молекулH2SO4 может
забрать у металла не только два электрона
(и перейти в
из молекулH2SO4 может
забрать у металла не только два электрона
(и перейти в  ),
но и шесть электронов (и перейти в
),
но и шесть электронов (и перейти в )
и даже восемь (и перейти в
)
и даже восемь (и перейти в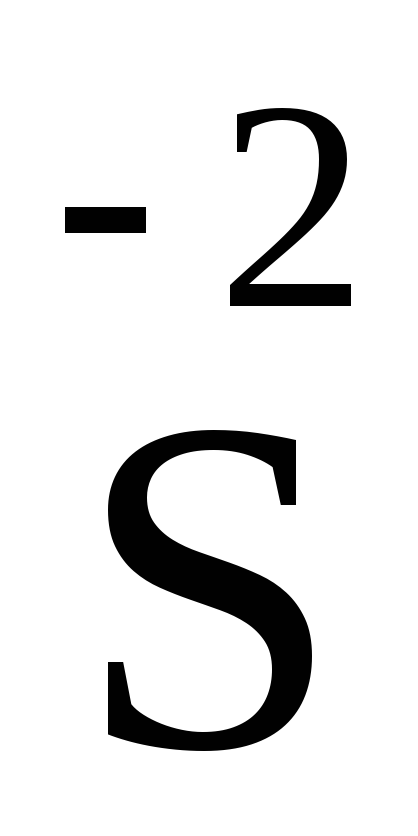 ):
):
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O,
3Zn + 4H2SO4(конц) = 3ZnSO4 + S + 4H2O,
4Zn + 5H2SO4(конц) = 4ZnSO4 + H2S + 4H2O.
Свинец с концентрированной серной кислотой взаимодействует с образованием растворимого гидросульфата свинца (II), оксида серы (IV) и воды:
Pb + 3H2SO4 = Pb(HSO4)2 + SO2↑ + 2H2O.
Холодная H2SO4(конц) пассивирует некоторые металлы (например, железо, хром, алюминий), что позволяет перевозить кислоту в стальной таре. При сильном нагревании концентрированная серная кислота взаимодействует и с этими металлами:
2Fe
+ 6H2SO4(конц)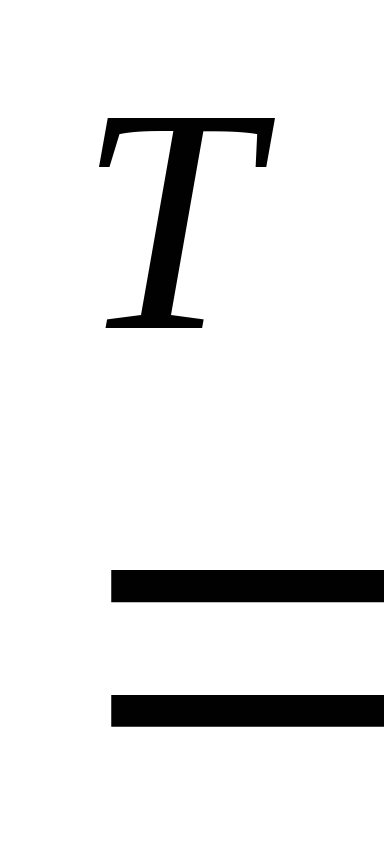 Fe2(SO4)3 + 3SO2 + 6H2O.
Fe2(SO4)3 + 3SO2 + 6H2O.
Взаимодействие металлов с азотной кислотой. Окислительная способность азотной кислоты определяется анионом NO3, окислительный потенциал которого значительно выше, чем ионов H+. Поэтому при взаимодействии металлов с HNO3 водород не выделяется. Нитрат-ион NO3 , имеющий в своём составе азот в степени окисления (+ 5), в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3 может протекать с образованием различных веществ по следующим схемам:
NO3 + 2H+ + e = NO2 + H2O,
NO3 + 4H+ + 3e = NO + 2H2O,
2NO3 + 10H+ + 8e = N2O + 5H2O,
2NO3+ 12H+ + 10e = N2 + 6H2O,
NO3+ 10H+ + 8e = NH4+ + 3H2O.
Азотная кислота обладает окислительной способностью при любой концентрации. При прочих равных условиях проявляются следующие тенденции: чем активнее металл, реагирующий с кислотой, и чем меньше концентрация раствора азотной кислоты, тем более глубоко она восстанавливается.
Это можно пояснить следующей схемой:
 ,
, 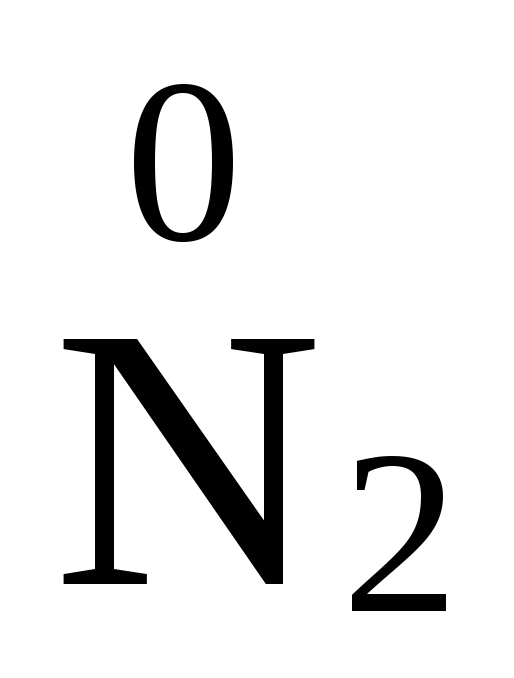 ,
,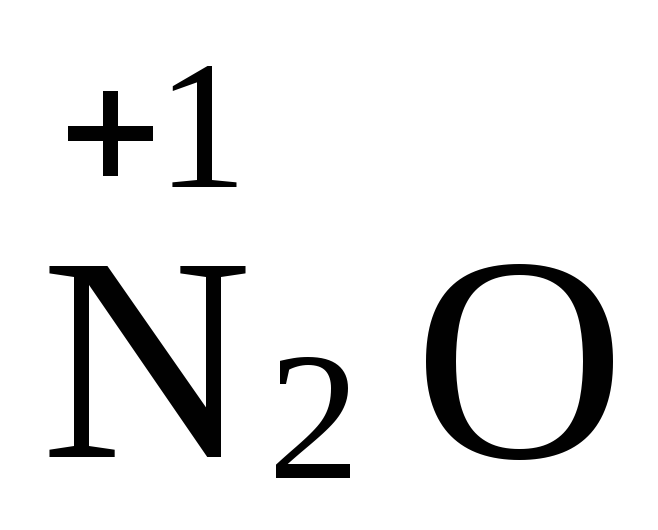 ,
,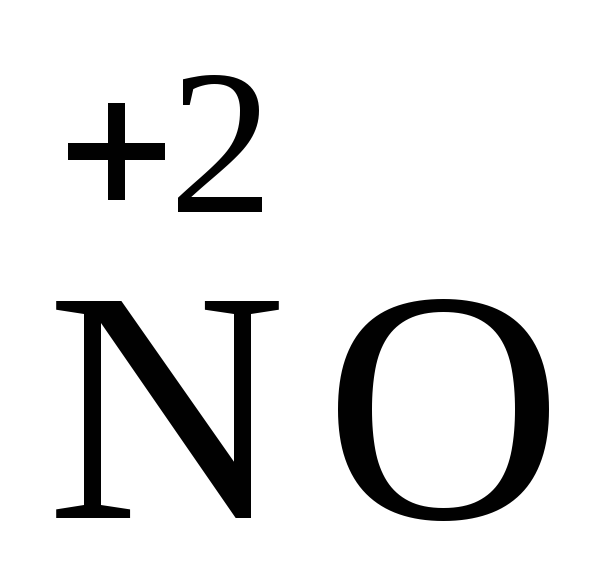 ,
,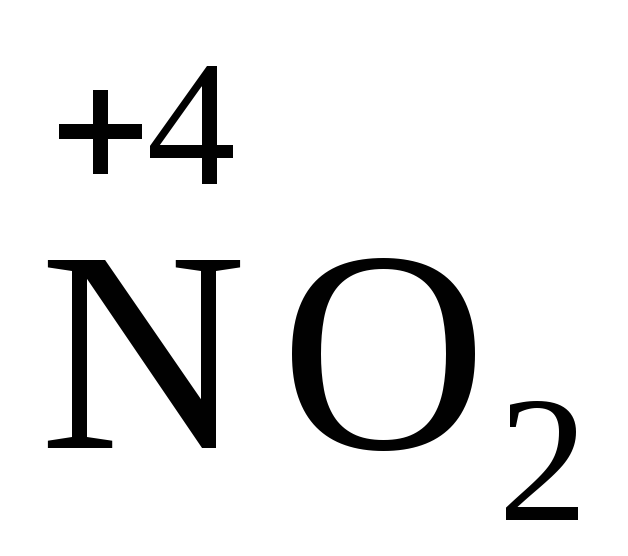
Концентрация кислоты
Активность металла


Окисление веществ азотной кислотой сопровождается образованием смеси продуктов её восстановления (NO2, NO, N2O, N2, NH4+), состав которых определяется природой восстановителя, температурой и концентрацией кислоты. Среди продуктов преобладают оксиды NO2 и NO. Причём при взаимодействии с концентрированным раствором HNO3 чаще выделяется NO2, а с разбавленной – NO.
Уравнения окислительно-восстановительных реакций с участием HNO3 составляются условно, с включением только одного продукта восстановления, образующегося в большем количестве:
Me + HNO3 Me (NO3)n + H2O + NO2 (NO, N2O, N2, NH4+).
Например, в газовой
смеси, образующейся при действии на
достаточно активный металл цинк (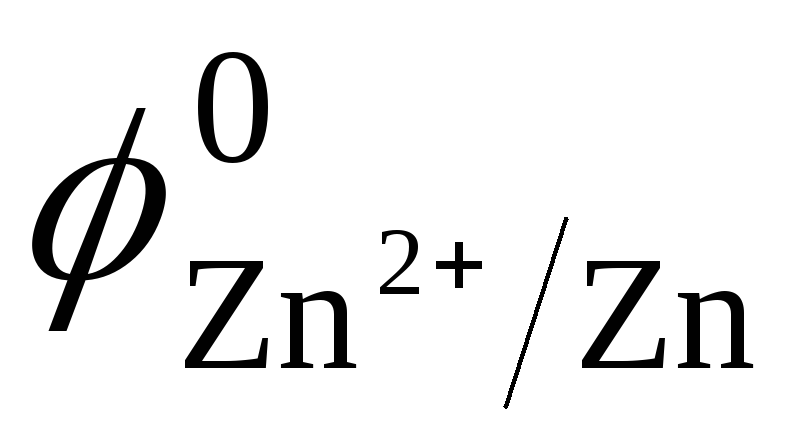 =
— 0,76 B)
концентрированной (68%-й) азотной кислоты,
преобладает – NO2,
40%-й – NO;
20%-й – N2O;
6%-й – N2.
Очень разбавленная (0,5%-я) азотная кислота
восстанавливается до ионов аммония:
=
— 0,76 B)
концентрированной (68%-й) азотной кислоты,
преобладает – NO2,
40%-й – NO;
20%-й – N2O;
6%-й – N2.
Очень разбавленная (0,5%-я) азотная кислота
восстанавливается до ионов аммония:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O,
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO + 4H2O,
4Zn + 10HNO3(20%) = 4Zn(NO3)2 + N2O + 5H2O,
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2 + 6H2O,
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O.
С
малоактивными металлом медью (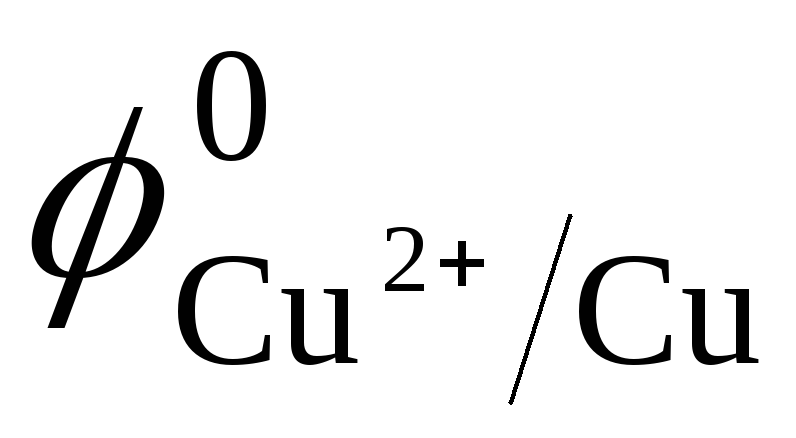 =
+ 0,34B)
реакции идут по следующим схемам:
=
+ 0,34B)
реакции идут по следующим схемам:
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O,
3Cu + 8HNO3 (разб) = 3 Cu(NO3)2 + 2NO + 4H2O.
В концентрированной HNO3 растворяются практически все металлы, кроме Au, Ir, Pt, Rh, Ta, W, Zr. А такие металлы как Al, Be, Bi, Co, Cr, Fe, Nb, Ni, Pb, Th, U, а также нержавеющие стали пассивируются кислотой с образованием устойчивых оксидных плёнок, плотно прилегающих к поверхности металла и защищающих его от дальнейшего окисления. Однако Al и Fe начинают растворяться при нагревании, а Cr устойчив к действию даже горячей HNO3:
Fe
+ 6HNO3 Fe(NO3)3 + 3NO2 + 3H2O.
Fe(NO3)3 + 3NO2 + 3H2O.
Металлы, для которых характерны высокие степени окисления (+6, +7, +8), с концентрированной азотной кислотой образуют кислородсодержащие кислоты. При этом HNO3 восстанавливается до NO, например:
3Re + 7HNO3 (конц) = 3HReO4 + 7NO + 2H2O.
В очень разбавленной HNO3 уже отсутствуют молекулы HNO3, существуют только ионы H+ и NO3. Поэтому очень разбавленная кислота (~ 3-5%) взаимодействует с Al и не переводит в раствор Cu и другие мало активные металлы:
8Al + 30HNO3(оченьразб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O.
Смесь концентрированных азотной и соляной кислот (1:3) называется царской водкой. Она растворяет Au и платиновые металлы (Pd, Pt, Os, Ru). Например:
Au + HNO3(конц.) + 4HCl = H[AuCl4] + NO + 2H2O.
Указанные металлы растворяются в HNO3 и в присутствии других комплексообразователей, но процесс протекает очень медленно.
Взаимодействие воды с металлами, опыт эксперта

Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями. Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода. Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH+ → Men+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
NaH + H2O ® NaOH + H2
NaH + HCl ® NaCl + H2
 Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nh3O → 2Me(OH)n + nh3 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2h3O → Ca(OH)2 + h3↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nh3O Me2On + nh3 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде. Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
Вконтакте
Google+
Тяжелые металлы в воде: содержание, определение и анализ
Отбор воды для Химического анализа
Тара
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
Отбор проб
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Отбор воды для Микробиологического анализа
Тара
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Отбор проб
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Доставка и хранение пробы
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Отправляя заявку, Вы принимаете соглашение об обработке персональных данных
Всё о металлическиих трубах для водопровода
Автор Пётр Андреевич На чтение 8 мин. Опубликовано
Чтобы трубопровод служил долго, он должен быть изготовлен из надёжных материалов. Если речь идет о водопроводных трубах, металлические можно назвать лучшими. Но и здесь нужно учитывать все особенности. Например, стальная труба на водопровод окисляется. Это не будет проблемой, если смонтировать систему по всем правилам, и воспользоваться рекомендациями, приведенными в настоящей публикации.
Традиционное назначение стальных труб
Несмотря на то, что современный рынок строительных материалов широк, и сейчас можно найти альтернативу, в качестве не сменного лидера выступают трубы водопроводные стальные. Став классикой, они всегда есть в наличии, и пользуются спросом, как у застройщиков, так и у частных домовладельцев.


С их помощью монтируется трубопроводы хозяйственно-питьевого водоснабжения новостроек, многоэтажных строений, жилых комплексов, дач и загородных коттеджей. Но нужно учитывать, что сборка систем водоснабжения и отвода производится с применением специфических технологий и методов.
Методы установки
За все время, пока человеком применяется металлическая труба для водопровода, способы монтажа остаются неизменными:
- Резьбовые соединения. Используются муфты с внутренними резьбами.
- Сварные соединения. Предполагает использование сварочного аппарата.
Методы можно комбинировать. В любом случае без специальных технических средств не обойтись. Исключение – фланцевые соединения при монтаже канализации.
Диаметральный размер: таблица
Принято измерять диаметр в дюймах. Чтобы пересчитать в метрическую систему, а именно в миллиметры, необходимо данные из таблицы умножить на 25,4. Если изначально в описании к товару имеется указание в миллиметрах, имеется в виду внутренний диаметр. Чтобы узнать, сколько это будет по наружной поверхности, нужно учесть толщину стенки. Все размеры в одной таблице.
Размер толщины стенок
Классификацию по толщине стенок определяет ГОСТ 3262-75. В документе говорится, что трубы бывают:
- легкими;
- стандартными;
- усиленными.
При оценке учитывается соответствие внутренних диаметров и толщин стенок. Даже если диаметр всего 2,5 см, а стенка имеет толщину 4 мм, труба относится к облегченному типу. Такие изделия используются для монтажа разводки систем водопровода или отопления.
Обычные трубы подходят для конструкций с высокой несущей способностью. Нарезка резьбы и сварка может вызвать затруднения, особенно если речь идет о нержавеющей стали. Без специальных средств, токарного станка, работы выполнить не получится. Усиленные трубы используются в системах с повышенным давлением. Главный недостаток – большая масса, что усложняет обработку, транспортировку и монтаж. Но у изделий из железа есть и преимущества.
Достоинства
Если есть возможность использовать все необходимые технические средства, можно смело использовать металлические водопроводные трубы, так как они характеризуются множеством преимуществ по сравнению с аналогами.
Механическая прочность
Это касается как внутренних воздействий (давления), так и внешних. Если водопровод приходится вмуровывать в пол, закапывать глубоко под землю или прокладывать в местах, где труба будет подвергаться внешним силам, этот материал незаменим. Это трубопроводы, которые способны выдерживать высокое давление воды без разрывов, если речь идет о бесшовном прокате (цельнокатаные).
Относительная дешевизна
Говорить о том, дорогие или дешевые железные трубы можно только если оценить срок их службы и стоимость затрат на обслуживание. Сама труба недорогая. Но коррозия, блуждающие токи, воздействие агрессивной среды сокращают эксплуатационный период. Трубопровод нужно утеплить, изолировать от влаги, а открытые участки обрабатывать антикоррозийным составом или красить.
Обилию любой арматуры
Ассортимент любого строительного супермаркета включает все необходимое для монтажа. Здесь фитинги, краны, переходники, муфты и многое другое. Замечательно, что все стандартизировано, и зная основные геометрические параметры несложно подобрать комплектующие. Иное дело – совместить все элементы в единую, целостную систему.
Низкий коэффициент теплового расширения
Трубопровод может быть уложен в стяжку, вмуровон в стену, оштукатурен. Нет опасности, что при температурных перепадах конструкция растрескается, или труба лопнет. Геометрические промеры остаются неизменными, что особенно хорошо, если нужно смонтировать водопровод горячей воды или теплотрассу.
Недостатки
Как и любой материал, металл или сплав не лишен недостатков. Все они проявляются со временем, и если сразу после сборки система работает эффективно, все может измениться уже через пару лет, и об этом нельзя забывать. Сразу после пуска пить воду нельзя, если нет специальных фильтров. Нужно чтобы все примеси технического характера вымыло из системы. Затем водопровод будет функционировать нормально. Но уже через пару лет может оказаться, что все не так хорошо на самом деле.
Подверженность коррозии
Ржавчина – главный враг стали. Уничтожается структура металла, что приводит к полному ее разрушению. Даже если трубопровод проложен в доме, где нет осадков, опасность появляется в виде образующегося конденсата, что ярко выражено на водопроводе для холодной воды. Любой контакт воды, железа и воздуха приводит к появлению очагов коррозии. Разрушительному воздействию подвергается не только наружная, но и внутренняя поверхность.
Уменьшения просвета трубы со временем
На металлической внутренней поверхности образуется нарост из ржавчины и других отложений. Это, в конечном счете, приводит к тому, что пропускная способность падает. В результате возрастает давление перед местом засора. А после него ситуация обратная. Напор с годами слабеет, и может стать недостаточным для эффективного использования трубопровода. Воды становится недостаточно, а на входе в систему образуется избыточное давление, что грозит порывом.
Отложения могут стать средой для разрастаний колоний бактерий. Вода в таких трубах непригодна для питья, и опасна для здоровья и жизни людей. Выявить источник проблемы невозможно, и чтобы избавиться от нее, придется произвести сплошную замену трубопровода. Это особенно важно в домах, запитанных от колодца или скважины, где вода не обрабатывается хлором, как то делается на фильтрационных станциях централизованного водоснабжения.
Трудоемкость монтажа и разборки
Демонтаж всегда связан с отходами. Чтобы разобрать железный трубопровод, его нужно порезать на куски. Раскрутить соединения далеко не всегда получается из-за того, что резьба закисла, приржавела, закрашена. Монтаж сопряжен с необходимостью использовать специальное оборудование. Самостоятельно выполнить работу невозможно, нужны помощники. Нарезка резьбы предполагает наличие токарного станка.
Большой вес
Дело не только в том, что железные трубы тяжело транспортировать. Сама конструкция имеет большую массу. Необходимо крепить стояки к панелям. В деревянном, ветхом здании или в доме, выстроенном по современным облегченным технологиям этого делать нельзя, чтобы не перегружать несущие конструкции.
Трубы из нержавейки
Главное преимущество этого материала в том, что он не требует дополнительного ухода. Коррозия ему не страшна, а прочность такая же, как и у железной трубы. Единственное, что может стать причиной преждевременной замены элементов фильтра – попадание окалины. Но есть и неотъемлемые недостатки, которыми характеризуются водопроводы из нержавеющей стали:
- Высокая себестоимость. Цена та такие трубы на порядок выше, и перед тем, как сделать окончательный вывод о целесообразности покупки, нужно сравнить варианты и оценить все альтернативные способы устройства водопровода.
- Сложные методы обработки. Нужна специальная сварка. Нарезка резьбы производится с применением специальных средств. Это в свою очередь дополнительно увеличивается сметную стоимость работ.
В остальном все плюсы и минусы (кроме коррозии) также присущи.
Чугунные водопроводные трубы
Этот материал тяжелее всего обрабатывается, стоит дороже, но правда, не ржавеет. Большой вес, хрупкость, склонность к раскалыванию от ударов создают трудности уже в процессе транспортировки. Если это канализация, тогда чугун вполне применим, чтобы собрать трассу из элементов с фланцами. Но стояки и разводку в квартирах и частных домах из чугунных труб делать дорого и слишком трудоемко.
Медные водопроводные трубы
Они не ржавеют, не зарастают внутри, легко обрабатываются. Главный недостаток – высокая цена. Отсутствие ржавчины не говорит о том, что медные трубы не окисляются. Просто этот процесс менее заметен. Весь монтаж нужно выполнять крайне аккуратно ввиду мягкости и податливости металла. А поврежденные элемент подлежит замене. Отходы стоят слишком дорого, чтобы такие водопроводы были популярными.
Заключение
Материалы много весят и тяжело обрабатываются. Служат они достаточно долго, но металлический водопровод требует дополнительных затрат на защиту и обслуживание. Железо ржавеет и гниет. Его нужно изолировать, что не исключает появление очагов коррозии на внутренней поверхности. Альтернативные технологии в ряде случаев могут оказаться более удобными, как, например, металлопластик.
Сталь, чугун, медь, любой иной сплав или металл – отличный проводник электричества. Это могут быть статические или индуктивные токи. Опасность не только для человека, но и для самого трубопровода. Если имеет место напряжение, электролиз в разы ускорить день, когда водопровод придет в негодность. В этом случае коррозия уничтожит железо намного раньше, чем обычная ржавчина.
Самостоятельно собрать металлический трубопровод невозможно. Необходимы специальные технические средства, станки, оборудование. Весит труба много, и можно перегрузить несущие конструкции здания. Но это не значит, что применение металлических труб для водопровода не рекомендуется.
Материал универсален, и стоит недорого (если это не медь и не нержавейка). Монтируются системы подачи технической, питьевой, холодной и горячей воды. Трубы применяются для устройства систем отопления (одноконтурной и друхконтурной). Окончательный выбор зависит от возможностей покупателя, его навыков, наличия оснащения и знаний строительных технологий и в сфере обработки металлов.
Спонсор статьи сайт Navigator-trub, данная компания реализует стальные трубы в Челябинске

металлы с водой
3)Взаимодействие металлов с H2O(примеры). 1. щелочные и щелочноземельные металлы легко реагируют с водой при обычной температуре с выделением водорода и образованием гидроксида; 2. менее активные металлы взаимодействуют с водой только в раскаленном виде с выделением водорода и образованием оксида. !!! Щелочные металлы – это I группа, А — главная подгруппа – Li, Na, K, Rb, Cs, Fr !!! Щелочно-земельные металлы – это II группа, А – главная подгруппа (Be, Mg не относятся) – Ca, Sr, Ba, Ra
Реакции
взаимодействия металлов с водой в общем
виде описываются
схемойMe+H2O→Me(OH)n+H2↑
Me -n(e)=Men+ (восстановитель) Е
-n(e)=Men+ (восстановитель) Е мет 2H++2(e)=H2
мет 2H++2(e)=H2 (окислитель) Е
(окислитель) Е 2Н/H2=-0,41
В
ΔE
2Н/H2=-0,41
В
ΔE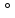 =-0,41-
Е
=-0,41-
Е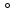 мет
мет 0
⟹
Е
0
⟹
Е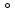 мет
мет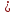 -0,41
В
-0,41
В
Реагировать с водой могут те металлы, потенциал которых менее -0,41 B. Практически в воде растворяются щелочные; Mg и щелочноземельные металлы, так как только их оксидные пленки растворимы в воде, а такие металлы, как алюминий, цинк, хром, титан, с водой не реагируют из-за явления пассивации.
Пример:
Растворение
(коррозия) Ca/CaO+H2O→
1.
CaO+H2O=Ca(OH)2 Ca+2H2O=Ca(OH)2+H2↑
2.
2Li +
2 H2O = 2 LiOH + H2 (протекает
реакция замещения) 3.
Al/Al2O3+H2O→
Al2O3+H2O→Al
не растворим в воде
(протекает
реакция замещения) 3.
Al/Al2O3+H2O→
Al2O3+H2O→Al
не растворим в воде
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.( Mn, Zn, Fe, Co, Ni, Sn, Pb)
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
Fe + H2O = FeO + H2 (протекает реакция замещения)
Ni + H2O = NiO + H2
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH +Si0 + H2+O= NaCl— + Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
